Anatomy of an Industry
Farmaceutische bedrijven verbergen niet langer hun financiële invloed op elke fase van het onderzoeksproces naar nieuwe (psychiatrische) medicijnen. Dit kwartaalthema brengt de bevooroordeelde opzet van onderzoeken, het verdraaien van de resultaten en het vervolgens aanprijzen van de medicijnen bij voorschrijvers in beeld.
Disclaimer
Mad in the Netherlands (MIA Global) geeft geen medisch advies met deze bronsectie en doet geen aanbevelingen met betrekking tot behandeling. Mad in the Netherlands wil mondiale informatie over psychiatrie toegankelijk en vindbaar maken in het kader van geïnformeerde toestemming. Wij wijzen u erop dat Mad in the Netherlands (MIA Global) niet verantwoordelijk kan worden gehouden voor de inhoud van de externe websites.
Bij navraag meldde de auteur Robert Whitaker aan Mad in the Netherlands (in mei 2022), dat er geen reactie of enige kritiek vanuit de industrie op deze studie gekomen is. Hij ontving geen enkel commentaar dat hij ergens fout zat in zijn onderzoek. Dit heeft ons doen besluiten om dit artikel als kwartaalthema op te nemen op onze website.
Robert Whitaker is een Amerikaanse journalist en auteur die talloze prijzen heeft gewonnen als journalist op het gebied van geneeskunde en wetenschap, waaronder de George Polk Award voor medisch schrijven en een National Association for Science Writers’ Award voor het beste tijdschriftartikel. In 1998 schreef hij mee aan een serie over psychiatrisch onderzoek voor de Boston Globe die finalist was voor de Pulitzer Prize for Public Service. Zijn eerste boek, Mad in America, werd door het tijdschrift Discover uitgeroepen tot een van de beste wetenschappelijke boeken van 2002. Anatomy of an Epidemic won in 2010 de Investigative Reporters and Editors Book Award voor beste onderzoeksjournalistiek.
Door Robert Whitaker – 18 september 2021
De Open Payments-wetgeving
De Federale Open Payments-wetgeving van 2013, die farmaceutische bedrijven verplicht hun directe betalingen aan artsen openbaar te maken, zou volgens de verwachtingen helpen om de corrumperende invloed van dit soort betalingen tegen te gaan. Als de betalingen openbaar zouden worden, zo was de gedachte, zouden medische faculteiten zich terughoudend opstellen om als auteur op te treden in ghostwriting papers waarin de resultaten van klinische tests worden gerapporteerd. Ook zouden zij zich niet meer laten betalen om promotiepraatjes te houden als bedrijven een afzetmarkt opbouwen voor hun pas goedgekeurde medicijnen.
De Centers for Medicare and Medicaid Services hebben onlangs de betalingen voor 2020 gepubliceerd. Er is nu dus een overzicht van de betalingen over een periode van zeven jaar beschikbaar, dat eenvoudig kan worden ingezien. Een onderzoek van Mad in America naar deze gegevens laat zien dat, hoewel de wetgeving inderdaad de deelname van academische psychiaters aan deze activiteiten heeft verminderd, de corrumperende invloed van farmaceutisch geld op alle fasen van het proces van het ontwikkelen van medicijnen – het testen van medicijnen, het rapporteren van de resultaten in tijdschriften en het verkopen van nieuw goedgekeurde medicijnen aan de medische gemeenschap – voortdurend aanwezig is. De corruptie is tegenwoordig dieper geworteld dan ooit.
In de psychiatrie bestaat er nu wat men zou kunnen omschrijven als een psychofarmacologische service-industrie, die kan worden onderverdeeld in drie sectoren. Er is een klein aantal academische psychiaters dat optreedt als consultant en adviseur voor bedrijven bij het uitvoeren van hun fase II en fase III studies. Samen met medewerkers van bedrijven zijn zij de auteurs van de gepubliceerde rapporten van deze studies. Er is een tweede, wat grotere groep psychiaters die verdere beoordelingen van de fase II en fase III resultaten schrijven en op die manier bijdragen aan een grotere bekendheid van de nieuwe medicijnen. De derde sector helpt bij het op de markt brengen van de medicijnen aan voorschrijvers. Psychiaters uit de eerste twee groepen spreken op congressen en fungeren als “faculteit” voor medische nascholingscursussen. Hun inspanningen worden ondersteund door een veel groter aantal gemeenschapspsychiaters tijdens hun ‘netwerkdiners’.
Het opmerkelijkste resultaat van de Open Payments-wetgeving is dat de farmaceutische bedrijven deze financiële invloed niet langer proberen te verbergen. Het gezicht van de commercie is zichtbaar in elke fase van het proces: de bevooroordeelde opzet van de onderzoeken, het verdraaien van de resultaten en het vervolgens aanprijzen van de medicijnen bij voorschrijvers. Dankzij de Open Payments-database kan nu gerapporteerd worden hoeveel geld er in elk stadium naar psychiaters gaat.
Inhoud van dit MIA-onderzoek
- Het eerste deel bespreekt de corruptie die het congres ertoe bracht de Open Payments-wetgeving aan te nemen. Vervolgens wordt gedetailleerd ingegaan op de geldstroom naar psychiaters die uit deze database kan worden afgeleid.
- Het tweede deel bekijkt hoe dit commerciële proces aanwezig was bij het testen en op de markt brengen van zeven nieuwe psychiatrische medicijnen die van 2013 tot 2017 door de FDA werden goedgekeurd. Daarnaast onderzoekt het hoe dankzij financiering regelmatig medicijnen die in klinische onderzoeken “geen zinvol klinisch voordeel” opleverden, werden veranderd in “veilige en effectieve” medicijnen die miljarden aan inkomsten opleverden voor de farmaceutische bedrijven.
DEEL 1; over corruptie, de open payments-database en de hieruit af te leiden geldstroom naar psychiaters
De weg naar openbare betalingen
De Food and Drug Administration (FDA) begon in 1962 farmaceutische bedrijven te verplichten te bewijzen dat hun geneesmiddelen veilig en effectief waren. In de daaropvolgende twee decennia huurden farmaceutische bedrijven regelmatig academische artsen in om hun studies uit te voeren. Zoals veteranen uit de industrie zich later herinnerden, moesten zij vaak met “de pet rond” om de academische artsen te vragen dit te doen. Subsidies van de National Institutes of Health waren destijds het betaalmiddel voor academische onderzoekers, niet financiering door de bedrijfswereld. Om academische onderzoekers zover te krijgen dat zij hun trials uitvoerden, moesten de farmaceutische bedrijven de controle over de studies aan hen afstaan. De academische onderzoekers zouden de proeven opzetten, de resultaten analyseren en de publicaties verzorgen zonder inmenging van de farmaceutische bedrijven.
Deze scheidingsmuur begon in 1980 te ontdooien toen het Congres de Bayh-Dole wet goedkeurde. Hierdoor konden academische onderzoekers die door de NIH gefinancierde vindingen hadden gedaan, hun vondsten in licentie geven aan geneesmiddelenbedrijven en er royalty’s voor krijgen. De individuele onderzoekers konden nu profiteren van het door het NIH gefinancierde onderzoek, en zo hadden academische onderzoekers een nieuwe reden om met het bedrijfsleven samen te werken. Deze impuls werd in de daaropvolgende jaren sterker toen het voor academische onderzoekers moeilijker werd om NIH-subsidies te krijgen.
Dit alles vond plaats op hetzelfde moment dat de American Psychiatric Association (APA), met de publicatie van de derde editie van haar Diagnostic and Statistical Manual (DSM III) in 1980, een ziektemodel had aangenomen voor het categoriseren van geestelijke stoornissen. De belangen van de psychiatrie als beroepsgroep en die van de farmaceutische industrie lagen nu perfect op één lijn.
Met het nieuwe ziektemodel van de APA, konden farmaceutische bedrijven medicijnen goedgekeurd krijgen voor een veel breder scala aan problemen. De markt voor psychiatrische middelen zou zich zeker drastisch uitbreiden. Tegelijkertijd omarmde de psychiatrie nu de psychofarmacologie – in tegenstelling tot gesprekstherapieën – als haar belangrijkste domein. Psychiaters behandelden nu “hersenziekten”, waarbij het voorschrijven van psychiatrische medicatie hun voornaamste functie werd. Zowel de industrie als de psychiatrie, handelende als een soort ‘gilde’. Ze hadden alle reden om nieuwe medicijnen aan te prijzen als veilig, effectief en beter dan bestaande behandelingen op de markt.
In de jaren ’80 begon de APA farmaceutische bedrijven toe te staan om “educatieve” lezingen te sponsoren op haar jaarlijkse conferentie. Deze lezingen werden gegeven door academische psychiaters die betaald werden door bedrijven. De APA en farmaceutische bedrijven verklaarden zelfs publiekelijk dat ze nu een “samenwerkingsverband” hadden om nieuwe medicijnen te ontwikkelen. Het geld van de farmaceutische bedrijven stroomde naar de APA voor verschillende doeleinden. Al snel betaalden de farmaceutische bedrijven academische psychiaters om op te treden als hun adviseurs, consultants en sprekers.
De farmaceutische industrie wierp een wijd net uit met haar geld en deze inspanning was zo compleet dat in 2000, toen het New England Journal of Medicine een expert zocht om een overzichtsartikel te schrijven over de behandeling van depressie, “er maar heel weinig gevonden werden die geen financiële banden hadden met farmaceutische bedrijven”. Psychiater Daniel Carlat vertelde aan de Boston Globe dat “ons vakgebied als geheel steeds meer gekocht wordt door de farmaceutische industrie: dit omvat de diagnoses, de behandelingsrichtlijnen en de nationale bijeenkomsten”.
In het volgende decennium werd het duidelijk dat deze “verovering” van de academische psychiatrie door de industrie ten koste was gegaan van het publiek. SSRI antidepressiva en atypische antipsychotica werden in de jaren ’90 aan het publiek gepresenteerd als “doorbraakmedicijnen”, maar uiteindelijk werd bekend, althans in bepaalde kringen, dat de resultaten van klinische onderzoeken naar deze twee klassen waren verdraaid om hun werkzaamheid te overdrijven en dat de schadelijke effecten van de medicijnen verborgen waren gehouden.
In 2007 begon senator Charles Grassley van Iowa te rapporteren over de hoeveelheid geld van de industrie die naar academische psychiaters stroomde die als adviseurs hadden gewerkt en in sprekersbureaus hadden gezeten. Hij noemde hierbij namen. Grassley vertelde over betalingen van de industrie aan Joseph Biederman, een professor aan de Harvard Medical School; aan Melissa Del Bello, een universitair hoofddocent aan de Universiteit van Cincinnati; aan Karen Wagner, directeur kinderpsychiatrie aan de Universiteit van Texas; en aan Charles Nemeroff, voorzitter van de afdeling psychiatrie aan de Emory Medical School. Van Frederick Goodwin, voormalig directeur van het National Institute of Mental Health (NIMH), werd onthuld dat hij meer dan een miljoen dollar had ontvangen voor het promoten van een stemmingsstabiliserend middel voor bipolaire stoornissen.
In het kielzog van deze onthullingen drong Grassley aan op wetgeving die zou voorzien in de publicatie van betalingen van de industrie aan artsen. Vanaf 2009 begonnen farmaceutische bedrijven afzonderlijk met het publiceren van deze gegevens op hun websites. Deze gegevens werden door ProPublica verzameld in jaarlijkse “Dollars for Doctors” rapporten. Vervolgens werden in 2013, als onderdeel van de Obama Affordable Care Act, alle farmaceutische bedrijven en fabrikanten van hulpmiddelen verplicht om directe betalingen aan artsen te rapporteren, met jaarlijkse rapporten die voor 30 juni van het daaropvolgende jaar moesten worden ingediend.
Men verwachtte dat deze “wet op de openbaarheid van bestuur” op zijn minst een gedeeltelijke oplossing zou bieden voor de corruptie die een bron van publieke zorg was geworden. Medische tijdschriften begonnen auteurs van artikelen ook te verplichten om financiële belangenconflicten bekend te maken (maar niet het bedrag.) Door deze transparantie zouden de conflicten bekend worden en, zo was de gedachte, zou dit een veranderd landschap opleveren voor het testen van medicijnen in klinische studies. Om hun reputatie te beschermen zouden academische artsen hun financiële banden met de industrie moeten verbreken, en zouden farmaceutische bedrijven gemotiveerd zijn om “onafhankelijke” onderzoekers te betalen om hun studies uit te voeren, omdat dit de gepubliceerde resultaten geloofwaardiger zou maken.
De “openheid” zou helpen om de corruptie op te ruimen.
Marktomvang
Zoals de Open Payments database laat zien, heeft de Open Payments wetgeving dit doel niet bereikt, in ieder geval niet op het gebied van de psychiatrie. Hoewel de samenstelling van de ontvangers van farmaceutisch geld is veranderd, doordat bezoldigde faculteiten aan academische medische scholen grotendeels zijn verdwenen van de farmaceutische loonlijsten, is de geldstroom naar psychiaters doorgegaan. Van 2014 tot 2020 hebben farmaceutische bedrijven $ 340 miljoen betaald aan Amerikaanse psychiaters om op te treden als hun consultants, adviseurs en sprekers, of om gratis eten, drinken en accommodatie te verstrekken aan degenen die promotionele evenementen bijwonen. Onderzoekssteun en betalingen voor nascholingscolleges/lezingen op vervolgopleidingen zijn niet inbegrepen in dit bedrag.
Van dit totaal was $ 212 miljoen bestemd voor sprekers en $ 33 miljoen voor adviesdoeleinden. De uitgaven voor reizen, eten en drinken hebben betrekking op het houden van toespraken of conferenties waar de farmaceutische bedrijven deze kosten betalen voor de psychiaters die er aanwezig zijn of er spreken.
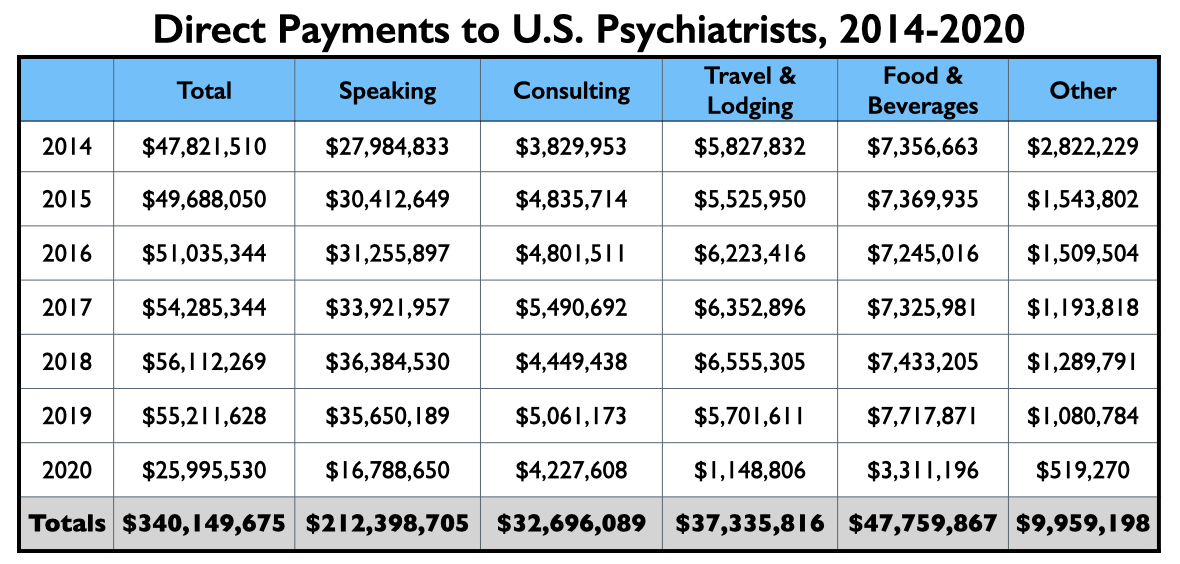
Zoals te zien is in de grafiek, varieerden de jaarlijkse bedragen van de betalingen van de industrie aan Amerikaanse psychiaters van $ 48 miljoen tot $ 56 miljoen van 2014 tot 2019. In 2020, als door de Covid-pandemie een einde komt aan conferenties en diners, daalden de betalingen van de industrie tot $ 26 miljoen.
In de jaren voor de Covid-pandemie verdienden ongeveer 250 psychiaters elk meer dan $ 50.000 voor hun diensten als spreker/consultant en nog eens ongeveer 500 psychiaters meer dan $ 10.000. Dit aantal vormt de kern van het aantal psychiaters dat jaarlijks een aanzienlijk bedrag aan de industrie verdient.
Open Payments vermeldt 31.784 psychiaters die van 2014 tot 2020 iets van waarde hebben ontvangen van de farmaceutische bedrijven, dat is ruwweg 75% van de psychiaters in de V.S. De meesten op deze lijst ontvingen een gratis maaltijd of drankje – deze aantallen vertellen over het bereik dat de industrie heeft als het gaat om het verlenen van op zijn minst één of twee gunsten aan psychiaters.
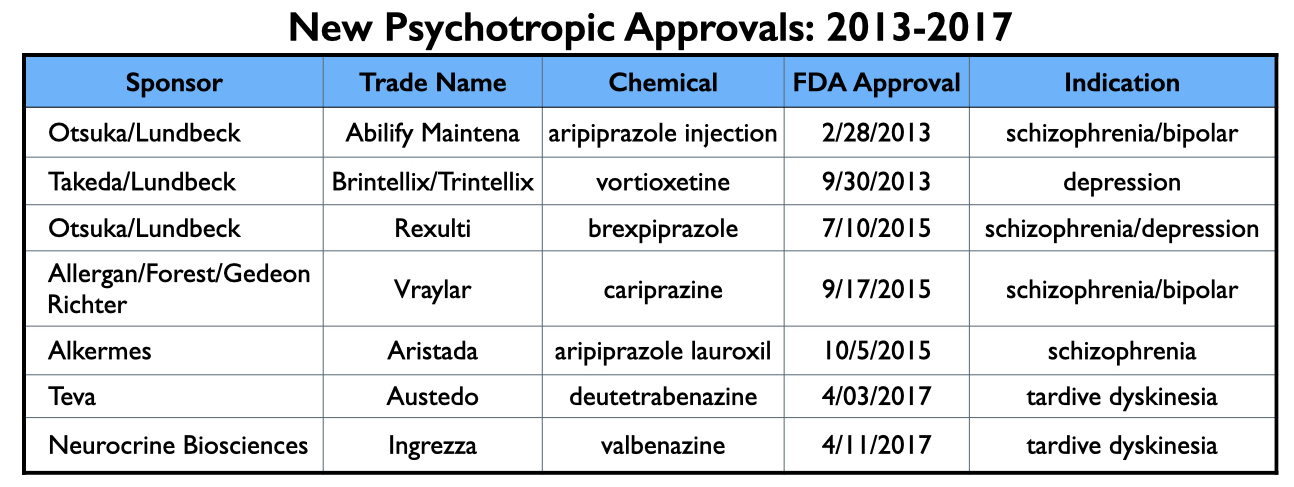
De FDA keurde zeven nieuwe psychotrope geneesmiddelen goed van 2013 tot 2017 (en werden dus op de markt gebracht in deze periode van 2014 tot 2020). Naar verwachting leverden de fabrikanten van deze zeven geneesmiddelen – Abilify Maintena, Brintellix/Trintellix , Rexulti, Vraylar, Aristada, Austedo en Ingrezza – het leeuwendeel van de promotionele betalingen aan Amerikaanse psychiaters in deze periode.
De Miljoen Dollar Club
Mad in America (MIA) heeft 62 Amerikaanse psychiaters geïdentificeerd die van 2014 tot 2020 directe betalingen ontvingen van farmaceutische bedrijven voor een totaalbedrag van $ 1 miljoen of meer. De topverdiener was Stephen Stahl, die $ 8,6 miljoen verdiende, waarvan $6,6 miljoen afkomstig was van Takeda, dat in 2013 het antidepressivum Brintellix op de markt bracht. Takeda betaalde hem 3,3 miljoen dollar voor zijn promotie van dit medicijn van 2014 tot en met 2018.
Om deze miljoenenlijst samen te stellen, heeft MIA twee online databases doorzocht: ProPublica’s Dollars for Docs voor 2018 (dat is het laatste jaar dat op de site beschikbaar is), en de Open Payments-database van 2014 tot 2020. Terwijl de Open Payments database niet kan worden gebruikt om een lijst te genereren van psychiaters die van boven naar beneden zijn gesorteerd op het totaal dat ze hebben ontvangen in deze periode van zeven jaar, kan de website van ProPublica wel zo’n lijst voor 2018 leveren. Dus identificeerde MIA eerst een lijst van 150 psychiaters die in 2018 meer dan $ 100.000 verdienden, en controleerde vervolgens het totaal dat elk van hen verdiende van 2014 tot 2020, volgens de Open Payments-database.
Dat leverde een lijst op van 62 psychiaters die het tot de Miljoen Dollar Club schopten. We voerden ook een steekproef uit onder psychiaters die in 2018 tussen $ 50.000 en $ 100.000 betaald kregen voor hun diensten aan farmaceutische bedrijven, maar geen enkele raakte de grens van $ 1 miljoen voor die zeven jaar. Daarnaast gebruikten we de Open Payments-database om betalingen te doorzoeken van de farmaceutische bedrijven die van 2013 tot 2017 nieuwe geneesmiddelen op de markt brachten en identificeerden we de vijf of zes psychiaters die door elk bedrijf het meest betaald waren. Dit leverde geen nieuwe namen op voor de lijst.
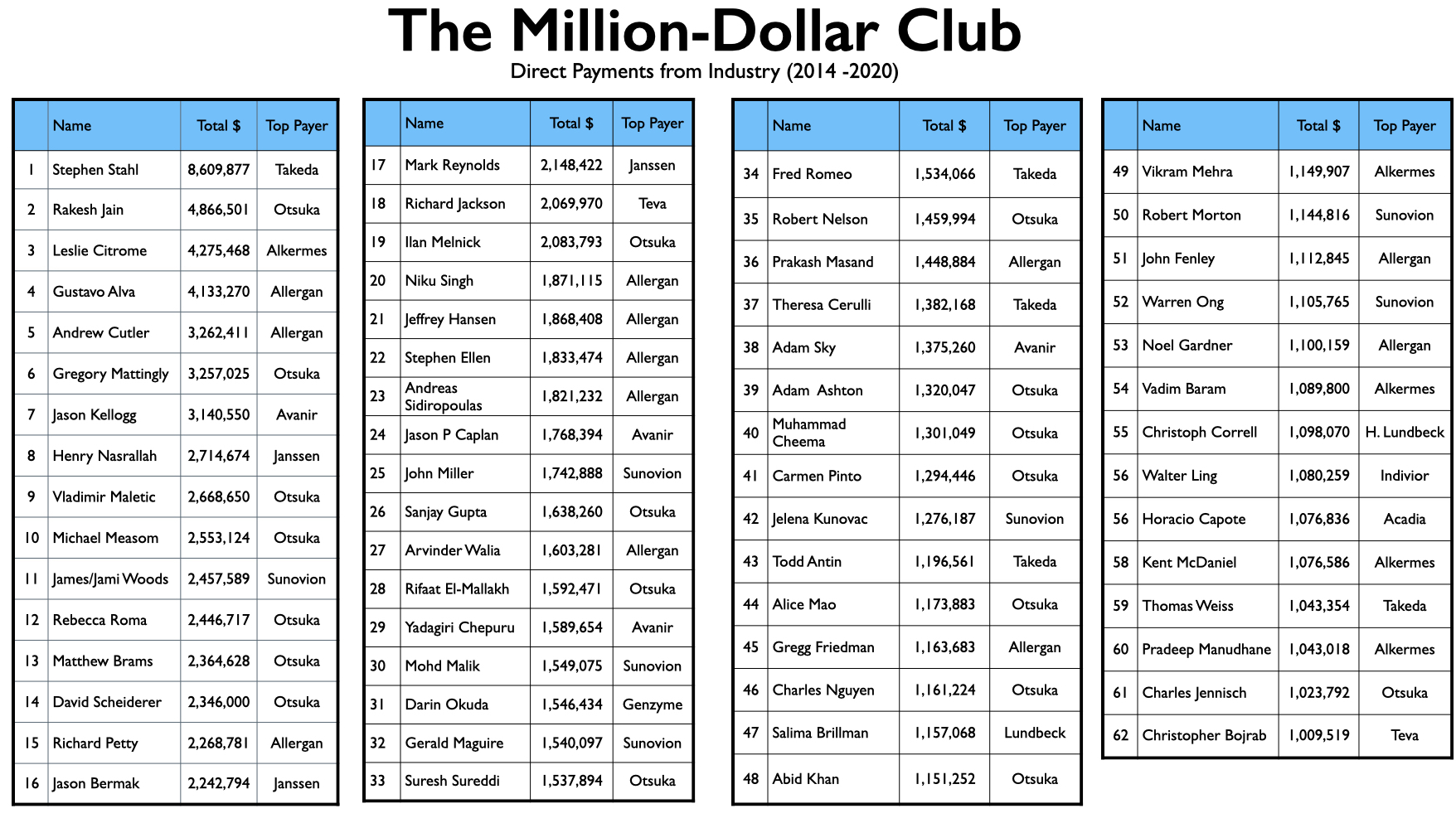
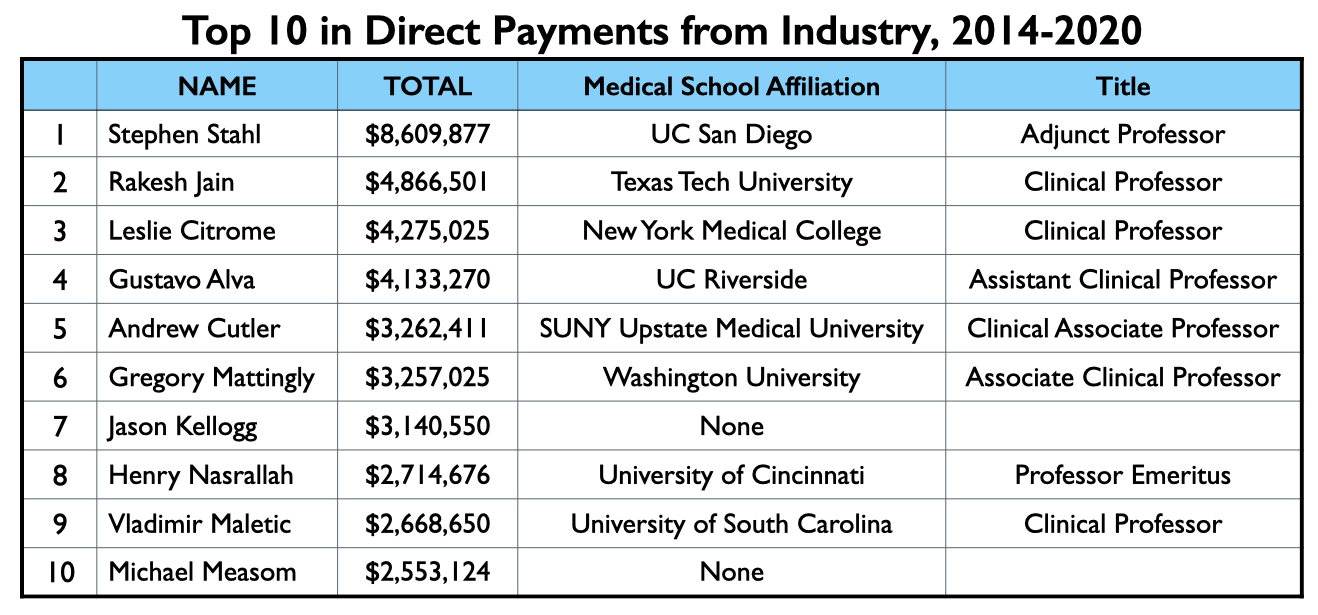
De lijst van 62 namen is opmerkelijk vanwege de relatieve afwezigheid van academische psychiaters die bekend staan om hun onderzoek. Voor het grootste gedeelte bestaat de Miljoen Dollar Club uit psychiaters met klinische aanstellingen bij medische scholen, wat vaak vergeleken wordt met het dienen als “adjunct” faculteit. Daarnaast hebben ze privé praktijken en werken ze in de gemeenschap. Er zijn maar weinig gesalarieerde faculteiten aan medische faculteiten in deze Miljoen Dollar Club, en er staan een behoorlijk aantal psychiaters op de lijst die geen enkele binding hebben met een academische medische faculteit.
Dit geldt zelfs voor de top 10 op de lijst. Er zijn geen bezoldigde professoren in deze groep. Van de 10 hebben er 7 klinische aanstellingen bij medische scholen, 1 is professor emeritus en 2 hebben geen actuele band met een medische school.
Hoewel de psychiaters in de Miljoen Dollar Club de farmaceutische bedrijven geen academisch aanzien verlenen, verschaffen zij – als groep – de industrie wel een reeks nuttige diensten, zoals het schrijven van publicaties over psychofarmacologie, het publiceren van recensies van nieuwe medicijnen in tijdschriften, het zitting nemen in redactieraden van tijdschriften die recensies van nieuwe medicijnen publiceren, het runnen van bedrijven voor nascholing, enzovoorts. En dan is er nog het sprekerscircuit: een aantal psychiaters in de miljoenenclub geven meer dan 50 betaalde lezingen per jaar.
Zoals hierboven vermeld, staat Stephen Stahl aan het hoofd van deze lijst. Hij heeft van 2014 tot 2020 $ 8,6 miljoen ontvangen van farmaceutische bedrijven, waarvan 80% voor “het optreden als faculteit of als spreker op een andere plaats dan een programma voor nascholing”. Stahl mag dan slechts een klinische aanstelling hebben aan een medische school (UC San Diego), hij is een ster in de psychofarmacologische wereld.
In 1991 kreeg Stahl een terugslag in zijn carrière toen het Office of Scientific Integrity van het U.S. Department of Health and Human Services vaststelde dat hij, destijds professor in de psychiatrie aan de Stanford University, hoofdauteur was geweest van twee artikelen die “ernstig misleidend” waren. Stahl maakte zich bovendien schuldig aan plagiaat in een hoofdstuk van een boek dat hij geschreven had. Stahl verliet Stanford voor een positie aan de UC San Diego en, in zeer korte tijd, was dit mini-schandaal vergeten. De afgelopen 25 jaar is hij waarschijnlijk de meest invloedrijke psychiater ter wereld geweest als het gaat om het gebruik van psychotrope medicatie. Zijn leerboek, Stahl’s Essential Psychopharmacology, en zijn klinische handleiding, Essential Psychopharmacology Prescriber’s Guide, zijn regelmatig te vinden in de boekenkasten van degenen die psychiatrische medicatie voorschrijven. In 2000 richtte hij het Neuroscience Education Institute (NEI) op, een medisch onderwijsbedrijf dat webinars en cursussen over psychofarmacologie geeft. NEI publiceert ook CNS-Spectrums, een peer-reviewed tijdschrift met Stahl als hoofdredacteur. Als nieuwe medicijnen worden getest en goedkeuring krijgen van de FDA, schrijft hij er regelmatig artikelen over, waarbij hij zich vaak richt op hun werkingsmechanisme en artikelen publiceert in zijn eigen tijdschrift. Zoals zijn bio op de website van het Neuroscience Education Institute vermeldt, is hij een veelgevraagd spreker in het lezingencircuit:
“Lezingen, cursussen en co-schappen gebaseerd op zijn tekstboeken hebben hem naar tientallen landen op 6 continenten gebracht om te spreken voor tienduizenden artsen, professionals in de geestelijke gezondheidszorg en studenten op alle niveaus. Zijn lezingen en wetenschappelijke presentaties zijn verspreid in de vorm van meer dan een miljoen CD-ROM’s, internet onderwijsprogramma’s, videobanden, audiotapes en programmateksten voor thuisstudie voor aanvullende medische opleiding aan honderdduizenden professionals in vele verschillende talen. Zijn cursussen en bekroonde multimedia lesmaterialen worden gebruikt door psychofarmacologie docenten en studenten over de hele wereld. Dr. Stahl schrijft ook didactische artikelen voor professionals in de geestelijke gezondheidszorg in talrijke tijdschriften.”
Het NEI belooft openlijk aan farmaceutische bedrijven dat het hen kan helpen hun geneesmiddelen te verkopen. Het congres van 2021, dat gepland staat voor november, bevat presentaties van een aantal van de favoriete sprekers van de industrie. De farmaceutische bedrijven worden aangespoord om te betalen voor presentaties die hen zullen helpen “in contact te komen met meer dan 2000 in de VS gevestigde professionals in de geestelijke gezondheidszorg, waarvan 95% voorschrijfbevoegdheid heeft”. Farmaceutische bedrijven kunnen ook betalen voor het “hosten” van symposia om “een toegewijd publiek van voorschrijvers te onderwijzen”. Samen bieden de presentaties en symposia farmaceutische bedrijven de mogelijkheid om “de merkherkenning te vergroten en de belangstelling van de aanwezigen voor uw product te wekken”.
Rakesh Jain, een klinisch professor in de psychiatrie aan de medische faculteit van de Texas Tech Universiteit, staat op de tweede plaats van de miljoendollarlijst. Zijn cv van 41 pagina’s bevat een lange lijst van activiteiten die nuttig zijn voor farmaceutische bedrijven: hoofdonderzoeker bij klinische proeven (en af en toe auteur van onderzoeksresultaten); adviseur voor meer dan 15 farmaceutische bedrijven in de loop der jaren; regelmatige presentator in het CME-circuit; recensent voor meer dan een dozijn medische tijdschriften (de meeste met een focus op geneesmiddelentherapieën); talloze media-optredens; en spreker voor tientallen bedrijven. Farmaceutische bedrijven betaalden hem van 2014 tot 2020 $ 4,867 miljoen, waarvan 67% voor spreekdiensten, 19% voor “honoraria” en reiskosten, en 14% voor consulting. Hij verleende diensten aan meer dan 30 farmaceutische bedrijven in deze periode.
Nummer drie op de miljoenenlijst is Leslie Citrome, klinisch professor in de psychiatrie en gedragswetenschappen aan het New York Medical College in Valhalla, New York. Hoewel hij niet de ster is zoals Stahl in de wereld van de psychofarmacologie, is hij wel een persoon met grote invloed. Hij is momenteel voorzitter van de American Society of Clinical Psychopharmacology. Het “officiële tijdschrift” van de vereniging is de Journal of Clinical Psychiatry, een favoriete plaats voor farmaceutische bedrijven om de resultaten van klinische onderzoeken te publiceren. De vereniging is ook een aanbieder van cursussen voor doorlopende medische educatie. Citrome adviseert farmaceutische bedrijven bij het testen en op de markt brengen van hun nieuwe medicijnen. Als een medicijn eenmaal is goedgekeurd, schrijft hij regelmatig reviews die op de een of andere manier meer inzicht geven in het bewijs voor de veiligheid en werkzaamheid ervan. Hij zit in het bestuur van 11 medische tijdschriften, en zoals zijn LinkedIn profiel vermeldt, heeft hij “veel lezingen gegeven in de VS, Canada, Europa en Azië”.
Farmaceutische bedrijven betaalden Citrome $ 4,275 miljoen voor zijn diensten van 2014 tot 2020, waarvan 55% voor lezingen en voordrachten, en nog eens 25% voor adviesdiensten. De resterende 20% was voor honoraria, subsidies, geschenken en reiskosten. Twaalf farmaceutische bedrijven betaalden hem meer dan $ 100.000 in deze periode van zeven jaar.
Een andere manier om bij de industrie op de sneltoets te komen voor spreekdiensten is om als hoofdonderzoeker te fungeren bij klinische proeven, of, nog beter, een bedrijf met winstoogmerk te leiden dat door de industrie gefinancierde klinische proeven uitvoert. Jelena Kunovac is een van de velen met deze ervaring op haar cv. In 2012 richtte ze Altea Research op in Las Vegas, en zoals op haar website staat, “werkt Altea samen met grote farmaceutische sponsors om klinische onderzoeken uit te voeren naar nieuwe medicijnen en behandelingen, voornamelijk op het gebied van psychiatrie.” Sinds 2014 heeft ze $ 1,276 miljoen betaald gekregen voor haar regelmatige aanwezigheid in het sprekerscircuit. Het grootste deel van dit werk kwam van drie bedrijven: Sunovion (Latuda); Alkermes (Aristada); en Otsuka (Rexulti en Abilify Maintena).
Prakash Masand, 35e op de lijst, doet het al lang goed als aanbieder van diensten op het gebied van medische bij- en nascholing. Als adjunct professor aan de Duke-National University of Singapore Medical School, richtte hij psychCME op. Nadat dat bedrijf in 2006 werd overgenomen door United Health Group, richtte hij een tweede CME (Continuing Medical Education) bedrijf op, Global Medical Education, dat in 2020 werd overgenomen door Clinical Care Options. Farmaceutische bedrijven geven steun aan na/bijscholingsbedrijven, die worden gebruikt om sprekers te betalen op scholingsevenementen. Maar omdat de bedrijven “onafhankelijk” de sprekers selecteren, zijn deze betalingen niet te zien in de Open Payments database. Dergelijke activiteiten zijn natuurlijk een andere manier waarop farmaceutische bedrijven een markt creëren voor hun nieuwe geneesmiddelen en uiteindelijk geld doorsluizen naar sprekers. Dit heeft Masand, als eigenaar van CME bedrijven, van aanzienlijke waarde gemaakt voor de industrie.
Op persoonlijk vlak kreeg Masand van 2014 tot 2020 $ 1,448 miljoen betaald, waarvan 84% voor spreek- en aanverwante reiskosten. Een groot deel van dit salaris kwam van Allergan voor het promoten van Vraylar, een antipsychoticum.
Anderen op de lijst hebben een carrière opgebouwd als spreker zonder enige academische connectie. Rebecca Roma bijvoorbeeld, een psychiater in de regio Pittsburgh, verdiende $ 2,446 miljoen van 2014 tot 2020, waarvan 90% voor spreek- en aanverwante reiskosten. Otsuka, Janssen, en Alkermes waren haar drie belangrijkste klanten. Op een vergelijkbare manier verdiende Christopher Bojrab, die de teampsychiater is van de Indiana Pacers, $1 miljoen gedurende de zeven jaar dat hij als spreker optrad voor zo’n half dozijn bedrijven. In zijn biografie staat dat hij meer dan 100 lezingen per jaar geeft.
Als psychiaters zich eenmaal in de top van toonaangevende sprekers bevinden, kunnen ze verwachten dat ze daar kunnen blijven, met name als ze banden ontwikkelen met meerdere bedrijven. De meeste mensen in de miljoenenclub hebben jaar na jaar een vast inkomen van zes cijfers (hoewel dergelijke betalingen in 2020 aanzienlijk zijn gedaald tijdens de pandemie, toen persoonlijke conferenties en evenementen verdwenen).
In 2013 publiceerde ProPublica een artikel waarin gedetailleerd werd beschreven hoe 22 artsen, op basis van onthullingen van de 15 grootste farmaceutische bedrijven, van 2009 tot 2012 meer dan $ 500.000 hadden verdiend voor hun spreek- en adviesactiviteiten. Van de 22 waren er 12 psychiater, en alle 12 komen prominent voor in de Open Payments-database. Maar liefst 5 van de 12 staan in de top 10 van de psychiatrische miljoenenlijst en 5 anderen zitten in de club. De overige 2 misten net het doel.
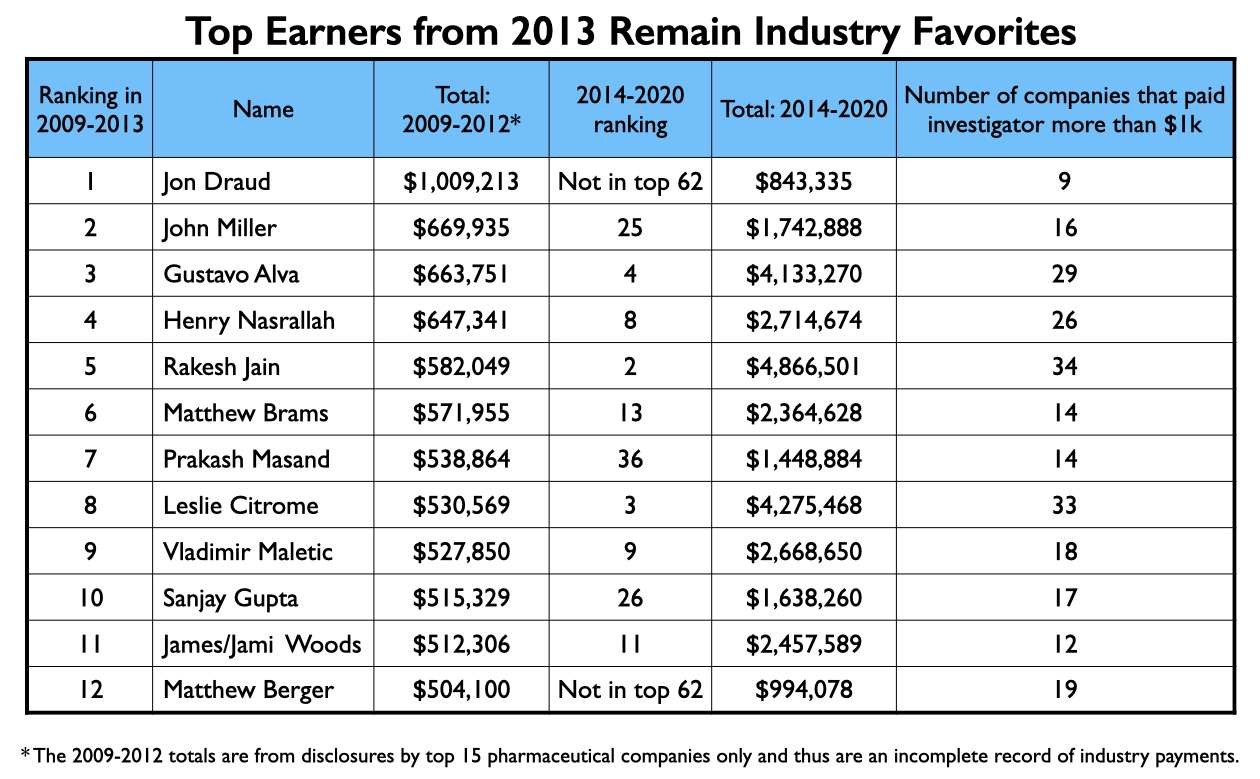
De meest prominente academische psychiater die opduikt in de Miljoen Dollar Club is Christoph Correll. Hij is professor in de psychiatrie aan de Donald and Barbara Zucker School of Medicine van Hofstra/Northwell en staat bekend om zijn onderzoek naar antipsychotica. Een andere prominente academicus op de lijst is Rifaat El-Mallakh, professor in de psychiatrie aan de Universiteit van Louisville School of Medicine, bekend om zijn expertise op het gebied van stemmingsstoornissen. Zijn verschijning op de lijst is enigszins verrassend gezien het feit dat hij verscheidene artikelen heeft geschreven over hoe antidepressiva tardieve dysforie kunnen veroorzaken en, meer in het algemeen, over hoe psychiatrische medicatie een “oppositionele tolerantie” kan opwekken die leidt tot langdurige “weerstand tegen behandeling” en chronische ziekte.
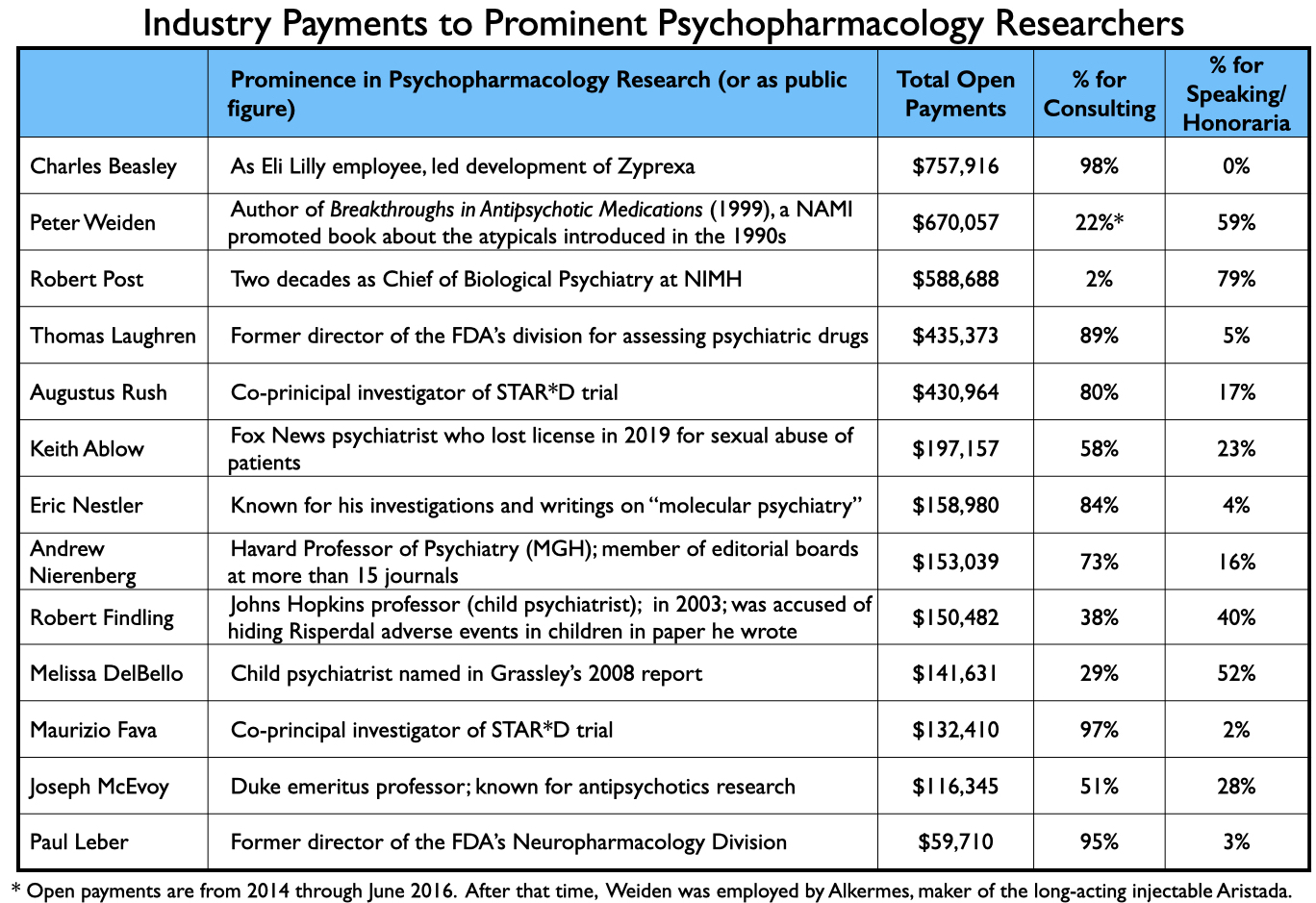
De betalingen aan academische psychiaters die als schrijvers optraden van artikelen over de zeven nieuwe middelen worden besproken in deel twee. Hier volgt een greep uit de betalingen aan andere prominente psychiaters die advies- of spreekdiensten hebben verleend aan de industrie van 2014 tot 2020:
De façade is weg
Vanuit het oogpunt van de volksgezondheid wordt verondersteld dat klinische proeven met nieuwe geneesmiddelen bewijzen opleveren waaruit blijkt dat een geneesmiddel veilig en doeltreffend is, en dus een medisch “voordeel” kan opleveren voor de samenleving. De gepubliceerde resultaten van deze proeven dienen dan als bevindingen die worden gepromoot onder voorschrijvers via leerboeken, CME-cursussen en conferenties die de medische gemeenschap “informeren” over wat de wetenschap heeft onthuld over een nieuw medicijn.
Wil het publiek die wetenschap vertrouwen, dan moet het geloven dat die vrij is van commerciële beïnvloeding. De proeven moeten worden uitgevoerd door onafhankelijke onderzoekers, en ook de latere beoordelingen van het geneesmiddel en de lezingen op de conferenties moeten vrij zijn van industriële smetten. Meer dan tien jaar geleden raakte het publiek ontgoocheld toen het ontdekte dat onder een façade van wetenschappelijke integriteit, met rapporten over de resultaten van klinische proeven waarin academische psychiaters als auteurs werden genoemd, de farmaceutische bedrijven nu de proeven ontwierpen, de resultaten analyseerden en als ghostwriter optraden voor de artikelen. De genoemde auteurs verleenden hun academisch prestige aan dit proces, alsof zij nog steeds degenen waren die het onderzoek controleerden.
Die façade is nu verdwenen. In dit tijdperk van openbaarmaking is de controle vanuit bedrijven op wetenschappelijk onderzoek, en het gebrek aan onafhankelijke tests van de medicijnen, nu heel zichtbaar.
Van 2013 tot en met 2017 keurde de FDA twee langwerkende varianten van aripiprazol goed, twee antipsychotica (getest voor meerdere indicaties), een antidepressivum, en twee geneesmiddelen voor tardieve dyskinesie. MIA nam een steekproef onder 22 gepubliceerde verslagen van de klinische testresultaten. Hoewel deze steekproef niet volledig is, is hij wel representatief.
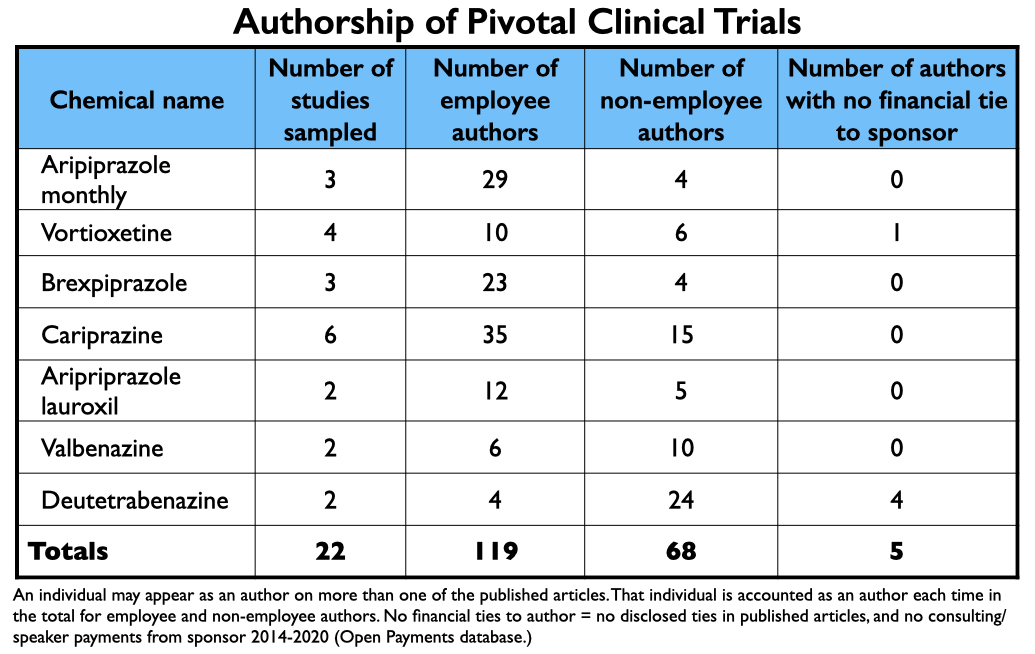
Elk artikel vermeldde ten minste twee bedrijfsmedewerkers als auteur. Terwijl meestal een niet-werknemer als hoofdauteur werd vermeld, werd in vier artikelen over cariprazine een werknemer als hoofdauteur vermeld. Het meest opmerkelijke is dat twee eigenaars van het octrooi op cariprazine als auteur werden vermeld in vijf van de door de MIA onderzochte artikelen.
In totaal waren er 187 genoemde auteurs in de 22 rapporten. Hiervan waren er 119 in dienstverband. Wat betreft de 68 niet-werknemers die als auteur werden genoemd, waren er slechts 5 gevallen waarin een auteur geen financiële band had met de sponsor, hetzij tijdens het onderzoek (zoals bekendgemaakt in het gepubliceerde rapport), of op enig moment tussen 2014-2020 (zoals bekendgemaakt in de Open Payments-database).
Aangezien een aantal auteurs in 2 of meer verslagen werd genoemd, bedroeg het aantal auteurs van verslagen veel minder dan 187.
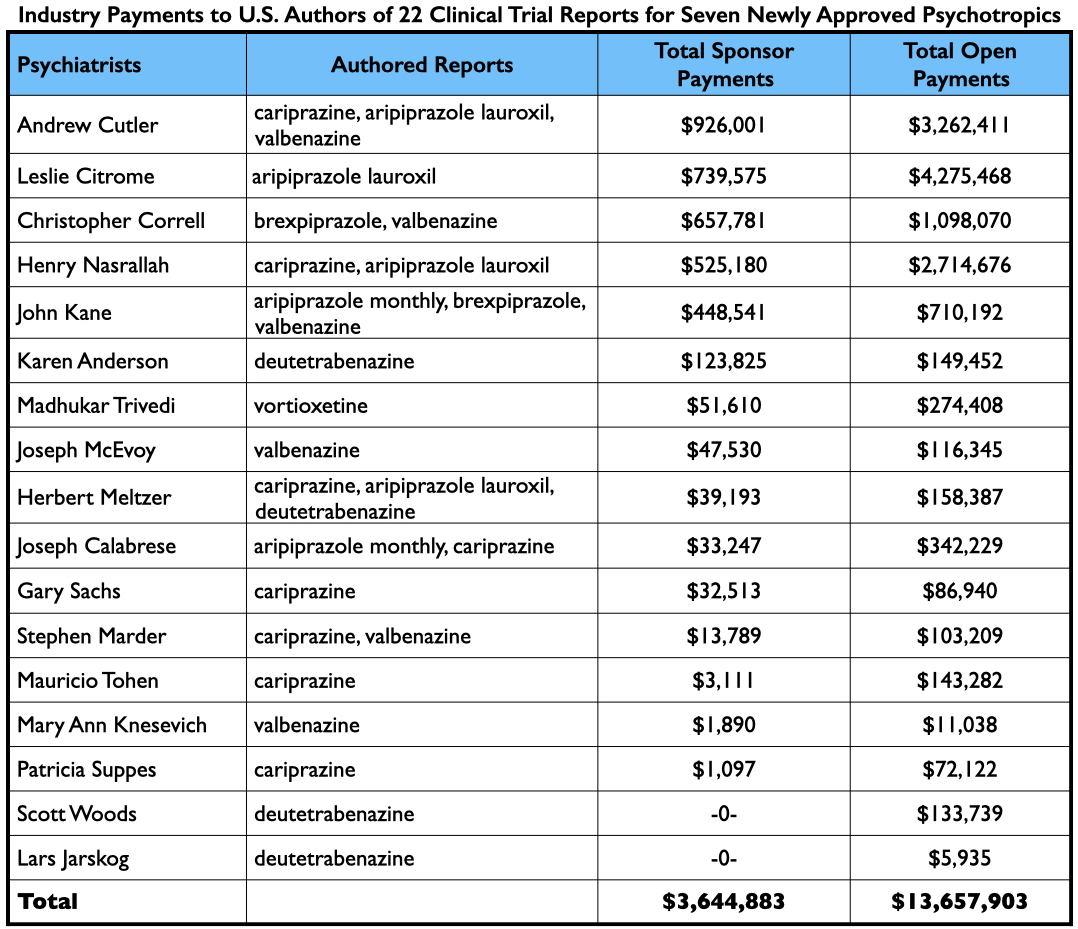
Veel van de onderzoeken werden in het buitenland uitgevoerd, en gezien het feit dat de meerderheid van de auteurs werknemers van bedrijven waren, stonden er verrassend weinig Amerikaanse psychiaters op de lijst van auteurs. Er stonden 17 Amerikaanse psychiaters en 8 Amerikaanse neurologen op de lijst van auteurs van de 22 rapporten (die in totaal 49 keer werden genoemd). Van deze 25 ontvingen er 23 betalingen van de farmaceutische bedrijven die de onderzoeken sponsorden, hetzij tijdens het onderzoek of na goedkeuring van de medicijnen door de FDA.
Als groep kregen de 25 Amerikaanse artsen $ 4,8 miljoen betaald voor hun adviesdiensten/sprekersdiensten aan de farmaceutische ondernemingen waarvan zij het geneesmiddel hadden “getest”. Velen van de 25 leverden echter consultatie- en/of sprekersdiensten aan een groot aantal andere farmaceutische bedrijven, wat bewijst dat zij een doorgeefluik (go-to groep) waren voor de industrie, met een collectief inkomen van $ 17,5 miljoen in de periode 2014-2020.
Onder het voorwendsel van wetenschap
Het feit dat de façade van een onafhankelijke beoordeling nu weg is, kan als een verbetering worden gezien. Het commerciële aspect is naar buiten gebracht. De pretentie dat de proeven een wetenschappelijke aangelegenheid zijn, blijft echter bestaan. En hoewel dit contra-intuïtief kan lijken, helpen de openbaarmakingsvereisten deze schijn te wekken.
In de gepubliceerde rapporten vermelden de bedrijven hun werknemers als auteurs en de niet-werknemers maken hun financiële banden met de sponsor en met andere farmaceutische bedrijven bekend. De lijsten met informatie over de niet-medewerkers kunnen eindeloos zijn en staan vaak in kleine lettertjes die moeilijk te lezen zijn. Maar deze “transparantie” wordt gepresenteerd als bewijs van naleving van de “sunshine laws”, en dus als onderdeel van een aanvaard wetenschappelijk proces. De gepubliceerde rapporten vertellen vervolgens over “statistisch significante” resultaten van “dubbelblind, placebogecontroleerd onderzoek”, wat taal is die de lezer duidelijk maakt dat dergelijke resultaten voortkomen uit een methodologisch juiste beoordeling van het medicijn.
Samen helpen de openbaarmakingen en de wetenschappelijke taal in de gepubliceerde rapporten om het overduidelijke te verdoezelen, namelijk dat het testen van psychiatrische medicatie – en het rapporteren van de resultaten – volledig plaatsvindt binnen een commerciële context. De farmaceutische bedrijven willen dat hun experimentele psychiatrische medicijnen “veilig en effectief” worden verklaard. Ze huren adviseurs in en verwachten dat die hen zullen helpen dit doel te bereiken. De invloed van het geld gaat allemaal in de richting van het bereiken van dat doel.
Bovendien is de betaling aan de auteurs van de testresultaten slechts de eerste stap in een proces van geneesmiddelenontwikkeling dat van begin tot eind doorspekt is met farmaceutisch geld.
De psychofarmacologische vaktijdschriften
Er worden maar weinig resultaten van klinische onderzoeken met psychiatrische medicatie gepubliceerd in prestigieuze medische tijdschriften. In plaats daarvan worden ze meestal gepubliceerd in tijdschriften die zich richten op “psychofarmacologie”. Dergelijke artikelen vertellen regelmatig over psychofarmaca die “veilig en effectief” zijn, met discussies over hoe de nieuwe middelen een soort therapeutisch voordeel kunnen bieden ten opzichte van bestaande middelen die op de markt zijn.
Een veelgebruikte bestemming voor dergelijke rapporten is het Journal of Clinical Psychiatry. Het mag dan geen prestigieus tijdschrift zijn, maar het heeft wel een grote impact: het tijdschrift stelt dat het het meest geciteerde “tijdschrift voor klinische psychiatrie” ter wereld is, met bijna 22.000 aanhalingen per jaar. Het is het officiële tijdschrift van de American Society of Clinical Psychopharmacology (ASCP).
Van de 22 hierboven beschreven rapporten zijn er 7 in dit tijdschrift gepubliceerd. Zodra de eerste onderzoeksresultaten zijn gepubliceerd, publiceren andere “deskundigen” in de psychofarmacologie, zoals Leslie Citrome en Stephen Stahl, bovendien overzichtsartikelen waarin het werkingsmechanisme van de medicatie wordt beschreven, de bevindingen van de klinische onderzoeken beschreven worden en de nieuwe medicatie vergeleken wordt met soortgelijke medicijnen die al op de markt zijn. Vaak suggereren deze artikelen dat het nieuwe medicijn een iets grotere werkzaamheid heeft of minder bijwerkingen heeft, een belangrijke aanwijzing die voorschrijvers ertoe kan aanzetten het medicijn te proberen. Het Journal of Clinical Psychiatry dient als een bakermat voor al deze artikelen.
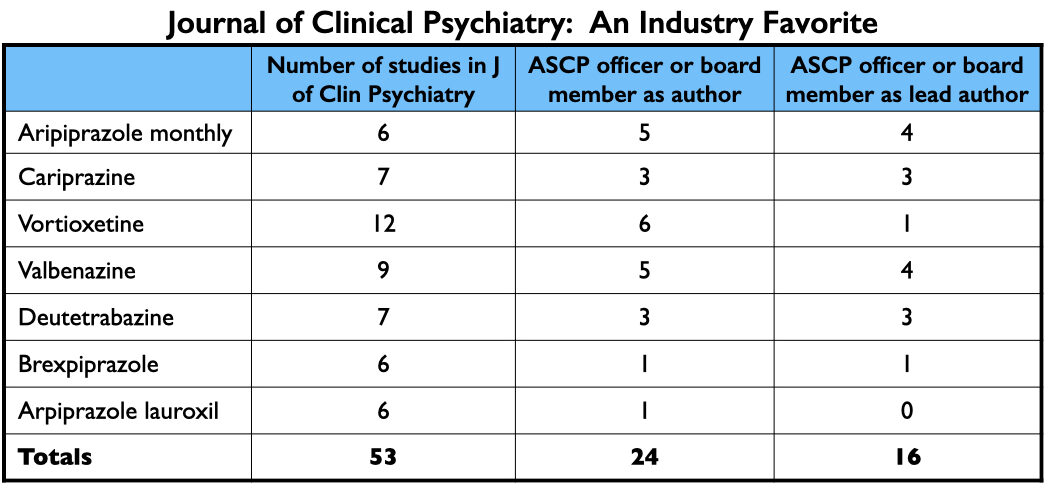
In totaal publiceerde het Journal of Clinical Psychiatry van 2013 tot 2017 ten minste 53 artikelen over de 7 goedgekeurde geneesmiddelen. Bij 24 artikelen stond een ASCP-functionaris of bestuurslid vermeld als auteur; bij 16 van de 53 artikelen was een ASCP-bestuurslid de hoofdauteur. Nagenoeg elke ASCP-official en elk ASCP-bestuurslid heeft financiële banden met de industrie.
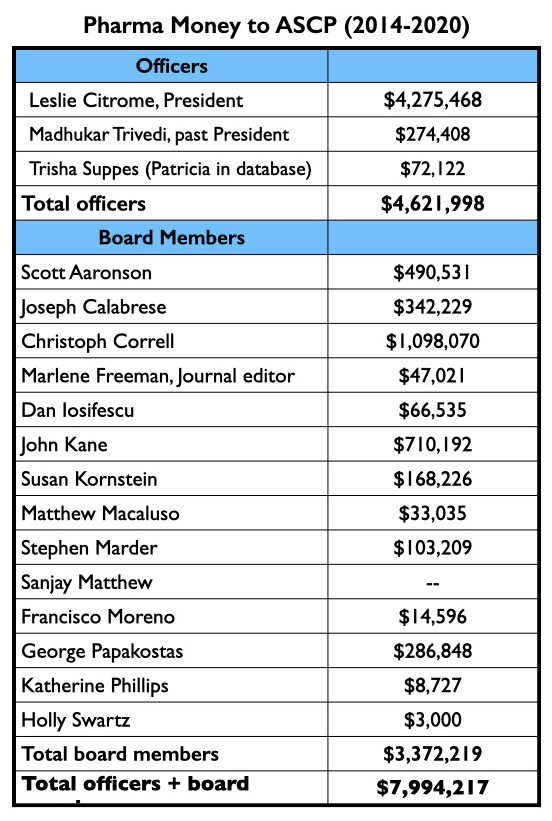
De 3 ASCP officieren, aangevoerd door Leslie Citrome, kregen gezamenlijk $ 4,62 miljoen betaald door farmaceutische bedrijven om als adviseur of spreker op te treden van 2014 tot 2020. De 14 bestuursleden van de ASCP ontvingen gedurende deze periode $ 3,37 miljoen voor deze doeleinden.
In totaal, gedurende de periode dat het Journal of Clinical Psychiatry minstens 53 rapporten publiceerde over de 7 nieuwe medicijnen, werden ASCP functionarissen en bestuursleden $ 8 miljoen betaald door farmaceutische bedrijven, waarbij het grootste deel van deze betalingen afkomstig was van de makers van de nieuwe medicijnen.
Een ander branchevriendelijk tijdschrift is CNS Spectrums. Zoals hierboven vermeld, is Stephen Stahl de hoofdredacteur en wordt het tijdschrift gepubliceerd door het door hem opgerichte bedrijf voor medische opleiding, Neuroscience Education Institute. CNS Spectrums publiceerde ten minste 71 artikelen over de 7 nieuwe farmaceutica, waarvan Stahl en Citrome elk 10 artikelen schreven.
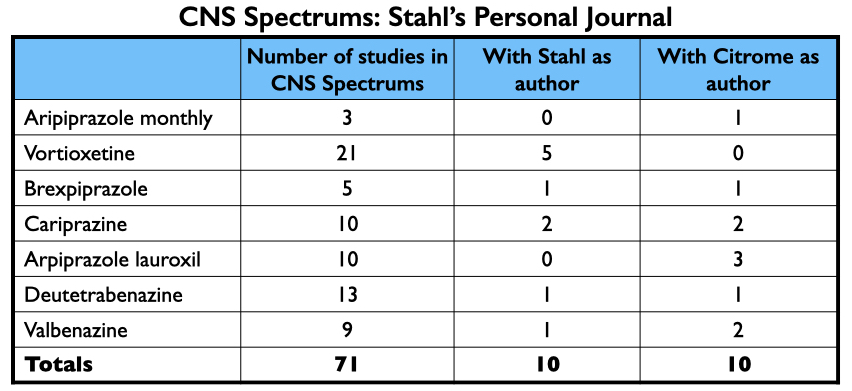
Samen kregen Stahl en Citrome van 2014 tot 2020 $ 12,9 miljoen betaald door farmaceutische bedrijven. Het grootste deel van deze financiering was voor het geven van lezingen: $ 6,9 miljoen voor Stahl; $ 2,4 miljoen voor Citrome.
De CME (Continuing Medical Education) bijscholinggeldboom
De Open Payments database geeft een overzicht van $ 340 miljoen aan directe betalingen van farmaceutische bedrijven aan Amerikaanse psychiaters van 2014 tot 2020. Daarnaast verstrekken farmaceutische bedrijven financiële middelen aan bedrijven voor medische vervolgopleidingen om cursussen en evenementen te organiseren. Deze financiering gaat weliswaar naar sprekers, maar is niet opgenomen in de Open Payments database omdat het opleidingsbedrijf, en niet het medicijnbedrijf, de sprekers selecteert. Het is dus geen directe betaling aan de sprekers. Deze sprekers zijn echter vaak dezelfde psychiaters die betaald worden door de farmaceutische bedrijven om op te treden als hun adviseurs en sprekers. Critici van deze praktijken hebben het vergeleken met “witwassen van geld“.
Van 2014 tot 2020 bedroegen de betalingen van de industrie aan opleidingsbedrijven in totaal $ 5,1 miljard. Een ruwe schatting, gebaseerd op beschikbare gegevens, is dat dit een extra $ 100 miljoen aan honoraria voor presentaties voor Amerikaanse psychiaters zal hebben opgeleverd gedurende deze periode.
Dat is het “grote plaatje” van de psychofarmacologische industrie. De invloed van al het geld vloeit in één richting, en bij elke stap – het ontwerpen van de klinische proeven, het publiceren van de resultaten, en het vervolgens bekend maken van die resultaten – wordt het geld besteed aan het vertellen van een verhaal dat zal resulteren in commercieel succes. Er wordt geen cent uitgegeven om het algemeen belang te dienen, wat een proces zou zijn dat is ontworpen om de algemene effecten van een geneesmiddel kritisch te beoordelen en deze bevindingen, zelfs als ze negatief zijn, aan de medische gemeenschap en het publiek mede te delen.
DEEL 2; over de rol van commercie in testfase en bij introductie nieuwe psychofarmaca (2013-2017) en veilige, effectieve medicijnen zonder klinisch voordeel
Belangrijk
Alle afbouwgidsen adviseren dat psychiatrische medicijnen nooit abrupt mogen worden stopgezet, tenzij er een zeer groot risico bestaat op een acute ernstige ziekte bij voortzetting.
Casestudies van 7 nieuwe psychiatrische medicijnen
Als de financiering van psychiaters door de industrie het testen van experimentele medicijnen en de daaropvolgende verspreiding van de resultaten niet in gevaar zou brengen, dan zou het misschien gezien kunnen worden als een commercieel proces dat niettemin berust op fatsoenlijke wetenschap. De 7 nieuwe psychiatrische medicijnen die van 2013 tot 2017 zijn goedgekeurd, bieden casestudies om te beoordelen of dat zo is.
Hier zijn enkele gemeenschappelijke elementen om naar te kijken bij het kritisch beoordelen van de verdiensten van klinische onderzoeksrapporten over psychiatrische medicijnen:
- Wordt er door de opnemingscriteria, of door het ontwerp van het protocol, geselecteerd op een subgroep van patiënten van wie verwacht kan worden dat ze goed zullen reageren op het onderzochte medicijn?
- Vormen de inclusie/exclusie criteria een subgroep van patiënten waarvan verwacht kan worden dat ze het slecht zullen doen wanneer ze worden overgezet op placebo?
- Is er een echte placebogroep in het onderzoek, of bestaat de placebogroep uit chronische patiënten die zijn gestopt met de psychiatrische medicatie die zij gebruikten?
- Zijn er meerdere doses van het onderzochte medicijn vergeleken met een enkele dosis placebo, waardoor het onderzochte medicijn “meerdere” kansen krijgt om een statistisch significant voordeel op te leveren?
- Is de statistisch significante bevinding van “werkzaamheid”, die vertelt over een puntverschil in vermindering van symptomen tussen de medicamenteuze behandeling en placebo, van klinische betekenis? Onderzoekers noemen deze norm het “minimaal klinisch belangrijk verschil”, en het vraagt regelmatig om een groter puntverschil dan een statistische significantie doet.
- Is de conclusie in de samenvatting in overeenstemming met de gegevens die in het artikel worden gepresenteerd?
De samenstelling van de placebogroep is uiteraard van bijzonder belang. Als dit een groep is die plotseling geen medicijn meer krijgt, kunnen deze patiënten allerlei psychiatrische en lichamelijke problemen ondervinden die de resultaten op effectiviteitsmetingen verslechteren en leiden tot een veel hogere incidentie van bijwerkingen dan het geval zou zijn bij het normale verloop van de “ziekte”.
Dit zijn allemaal vragen die kunnen worden onderzocht door de gepubliceerde rapporten te “ontleden”. Als deze manipulaties bestaan, zouden zij in de rapportages zichtbaar moeten zijn. Wat bij een dergelijk onderzoek onbekend blijft, is of een farmaceutisch bedrijf en zijn auteurs de presentatie van de gegevens hebben verdraaid of bijwerkingen hebben verborgen, en hoeveel mislukte trials nooit zijn gepubliceerd. Wat hieronder volgt is, op één uitzondering na, een overzicht van gepubliceerde artikelen waarin positieve resultaten voor de medicijnen worden gemeld.
Abilify Maintena (injecteerbare aripiprazol)
Otsuka en Lundbeck brachten Abilify Maintena, een langwerkende formule van aripiprazol, in 2013 op de markt als een behandeling voor schizofrenie en in 2017 als een onderhoudsbehandeling voor bipolair 1.
In verslagen van drie cruciale studies voor deze twee aandoeningen waren 18 van de 21 auteurs werknemers van het bedrijf. Twee van de drie niet-werknemers waren Amerikaanse psychiaters, John Kane en Joseph Calabrese. Kane was de hoofdauteur van twee schizofrenie-onderzoeken, terwijl Calabrese de hoofdauteur was van een bipolariteitsonderzoek. Beiden zijn bestuurslid van de American Society of Clinical Psychopharmacology.
De gepubliceerde resultaten
In de onderhoudsstudie voor schizofrenie, namen de onderzoekers 843 schizofreniepatiënten op die een “geschiedenis van symptoomverergering of terugval hadden wanneer ze geen antipsychotische behandeling kregen”. Alle deelnemers werden vervolgens “gecross-titreerd*” van het antipsychoticum dat ze hadden gebruikt naar oraal aripiprazol. Degenen die zich gedurende vier weken stabiliseerden op dit medicijn, werden overgezet op injecteerbaar aripiprazol, eenmaal per maand, en degenen die zich gedurende drie maanden stabiliseerden op het injecteerbare middel werden gerandomiseerd in een dubbelblind onderzoek, waarbij één groep het injecteerbare middel bleef gebruiken en de andere een placebo-injectie kreeg.
(Opmerking MitN: Sommige medicijnen moeten worden getitreerd (langzaam op- en/of afgebouwd). Hier werd het huidige antipsychoticum van de deelnemer afgebouwd (\) terwijl orale aripiprazol werd opgebouwd (/), kruislings (X) overlappend. Vandaar de naam cross-titrated, kruistitratie ofwel overlappende medicatie.)
Met deze opzet haalden 403 van de aanvankelijke 843 deelnemers de randomisatie. Slechts 10% van de groep die het medicijn kreeg toegediend, viel terug in de weken en maanden die volgden, tegenover 40% van de placebogroep. “De nieuwe IM-depot formulering van aripiprazol is effectief voor het voorkomen van terugval bij schizofrenie en vertegenwoordigt een alternatieve behandelingsoptie met een veiligheidsprofiel vergelijkbaar met oraal aripiprazol,” concludeerden Kane en de medewerkers van het bedrijf die het rapport schreven. Het artikel, dat werd gepubliceerd in het Journal of Clinical Psychiatry, was getiteld “Aripiprazole intramusculair depot als onderhoudsbehandeling bij patiënten met schizofrenie: een 52 weken durende, multicenter, gerandomiseerde, dubbelblinde, placebogecontroleerde studie.”
De onderhoudsstudie bij bipolaire 1-patiënten had een vergelijkbare opzet. Patiënten die een manische episode doormaakten, werden eerst gestabiliseerd op oraal aripiprazol en vervolgens gedurende enkele maanden op het injecteerbare middel. Deze selecte groep van goede responders op Abilify Maintena werd vervolgens gerandomiseerd naar voortzetting van de behandeling met het injecteerbare middel of placebo. 27% van de gemedicineerde patiënten ervoeren een stemmingsepisode tijdens de 52-weekse follow-up vergeleken met 51% van de placebo groep. “Deze bevindingen,” schreven Joseph Calabrese en de medewerkers van het bedrijf, “ondersteunen het gebruik van aripiprazol eenmaal per maand (AOM 400) voor de onderhoudsbehandeling van BP-1.”
De kritiek
De vooringenomenheid bij de opzet van deze studies is duidelijk. In de schizofreniestudie selecteerden de opnamecriteria patiënten die in het verleden slecht hadden gereageerd op het stoppen met antipsychotische medicatie, wat hielp bij het selecteren van patiënten van wie kon worden verwacht dat ze zouden verslechteren wanneer ze werden gerandomiseerd naar placebo. Vervolgens selecteerde het protocol, door middel van de uitgebreide stabilisatiefase, een groep van goede responders op Abilify Maintena (403 van 843 oorspronkelijke deelnemers). Bij de randomisatie had deze selecte groep een gemiddelde score van 54,5 op de Positive and Negative Symptom Scale (PANSS), wat betekent dat ze slechts “licht ziek” waren. Gezien de opzet van deze studie, konden degenen die gerandomiseerd waren voor voortzetting van de behandeling met Abilify Maintena verwachten dat ze stabiel zouden blijven, wat ook gebeurde. Hun PANSS scores bleven hetzelfde. Degenen die werden overgeschakeld op placebo begonnen echter binnen twee weken te verslechteren, waarbij hun PANSS-scores vrij snel stegen naar het midden van de 60, op welk punt velen werden geclassificeerd als bijna “terugval” en stopten met de studie. Tweeënzestig procent van de placebogroep kreeg te maken met “treatment emergent” bijwerkingen, zoals akathisia, angst, hoofdpijn en tremoren, allemaal bekende ontwenningsverschijnselen.
Maar zelfs gegeven deze bevooroordeelde opzet, was het 12-punts verschil in gemiddelde PANSS scores tussen de twee groepen aan het eind van de studie, 66 tegen 54, niet voldoende om een klinisch significant voordeel te bieden. PANSS is een schaal van 210 punten, en onderzoekers hebben vastgesteld dat er minstens een verschil van 15 punten tussen het geneesmiddel en het placebo moet zijn, wil het “voordeel” van de behandeling klinisch van belang zijn.
Daar komt nog bij dat vanaf het moment dat de patiënten voor het eerst werden toegelaten, slechts een kleine minderheid van de patiënten stabiliseerde op Abilify Maintena en stabiel bleef tijdens de dubbelblinde proef. Hoewel de rekensom een beetje ingewikkeld is, was het uitvalpercentage voor patiënten die werden behandeld met Abilify Maintena – hetzij in de stabilisatiefase of na te zijn gerandomiseerd naar de medicijngroep van het onderzoek – 72%. De onderzoekers stopten het onderzoek ook vroegtijdig, zodat er slechts 23 patiënten in het onderzoek waren die stabiel waren gebleven op Abilify Maintena gedurende 52 weken, een gedocumenteerd lange termijn “stabilisatie” percentage van 3%. Toch vertelde de titel van het gepubliceerde artikel hoe deze behandelingsmethode had bewezen een effectief “onderhoudsbehandeling” te zijn voor een volledig jaar.
Wat de bijwerkingen betreft, stierven 2 patiënten in de Abilify Maintena-groep, waarvan één aan een hartaanval, maar de onderzoekers concludeerden dat deze sterfgevallen “geen verband hielden” met de behandeling.
De cijfers zijn slechts iets beter voor het bipolaire onderzoek. Er waren 731 patiënten ingeschreven voor het onderzoek, en van deze groep stabiliseerden 266 patiënten goed genoeg op Abilify Maintena om te worden gerandomiseerd in het proefonderzoek. Van de 133 patiënten die werden gerandomiseerd naar de medicatie-groep, bleven er slechts 64 goed en in het onderzoek tot het einde ervan (52 weken). Er waren 598 patiënten die de kans hadden om zich te stabiliseren op het geneesmiddel en het te behouden na de randomisatie (731 min 133 gerandomiseerd naar placebo); het gedocumenteerde stabilisatiepercentage na één jaar voor deze consequent medicamenteuze groep was 11% (64/598).
Kane publiceerde een tweede onderzoek waaruit bleek dat Abilify Maintena een veilige en effectieve behandeling was voor acute verergeringen van schizofrenie. Zodra de resultaten van de cruciale studies waren gepubliceerd, publiceerden ook anderen besprekingen van de gegevens over Abilify Maintena, waardoor het gebruik ervan werd bepleit. Leslie Citrome schreef drie artikelen over Abilify Maintena, waarvan er één beschreef hoe hij een “hypothetisch model” had ontwikkeld om het te vergelijken met Invega, een langwerkend injecteerbaar middel dat al op de markt was. In deze vergelijking gaf Abilify Maintena betere klinische resultaten en minder heropnames, wat een aanzienlijke kostenbesparing voor de maatschappij zou opleveren, ook al waren de voorschrijfkosten van Abilify Maintena veel hoger dan die van Invega.
De geldboom
Hier volgt een overzicht van het industriegeld dat naar Kane, Calabrese en Citrome vloeide voor hun advies- en of sprekersdiensten specifiek gerelateerd aan Abilify Maintena van 2013 tot 2018 (ProPublica database), en hun totale betalingen van Lundbeck en Otsuka – de twee verkopers van Abilify Maintena – van 2014 tot 2020 (Open Payments database).
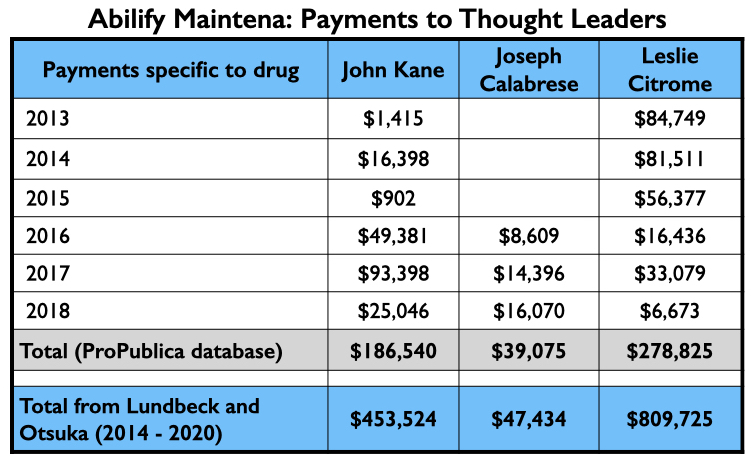
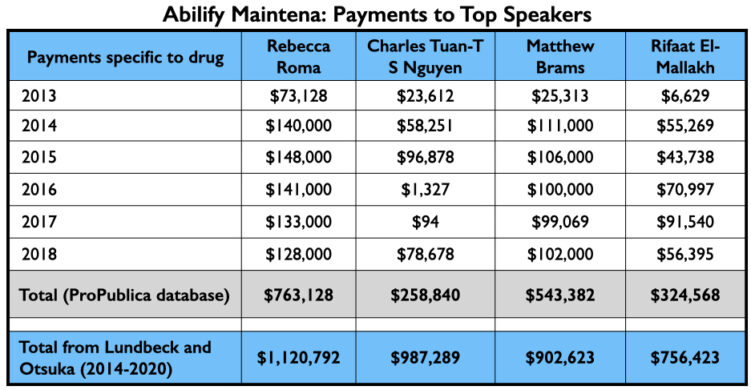
Toen Abilify Maintena eenmaal was goedgekeurd, stuurden Otsuka en Lundbeck hun sprekers de wereld in. Twee van hun vier best betaalde sprekers, Rebecca Roma en Charles Tuan-S Nguyen, verschenen regelmatig op Psych U, de naam die Otsuka en Lundbeck gaven aan hun online “educatieve diensten”. De derde, Matthew Brams, hielp Abilify Maintena te verkopen aan commissies die Medicaid betalingen voor medicijnen goedkeuren. De vierde, Rifaat El-Mallakh, bezorgde Otsuka en Lundbeck een spreker die academisch prestige kon verlenen aan hun promotie-inspanningen.
Hier is het geld dat zij verdienden voor het promoten van Abilify Maintena van 2013 tot en met 2018 (Pro Publica database), en het totaal dat ze verdienden aan Lundbeck en Otsuka van 2014 tot en met 2020. (Open Payments-database).
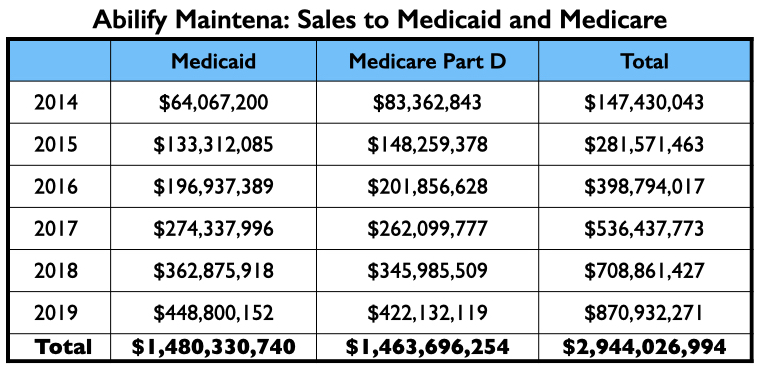
Dit driestappenproces – publicatie van de proefresultaten, verdere evaluatie van de proefresultaten en vervolgens de promotie van het middel door middel van dinergesprekken, conferenties en online presentaties – maakte Abilify Maintena tot een commercieel succes, met een verkoop aan Medicare* en Medicaid** alleen van in totaal $ 3 miljard van 2014 tot 2019. De verkoop aan particuliere zorgverzekeraars en de verkoop buiten de VS zijn niet inbegrepen in dit totaal.
(Opmerking MitN: *Medicare in de Verenigde Staten betreft een federaal programma dat gezondheidsdekking biedt aan 65+ of aan mensen met een handicap, ongeacht het inkomen. **Medicaid in de Verenigde Staten betreft een staats- en federaal programma dat gezondheidsdekking biedt als men een zeer laag inkomen heeft)
Trintellix/Brintellix (orale vortioxetine)
Takeda en Lundbeck verkregen in 2013 goedkeuring van de FDA voor vortioxetine als behandeling voor depressie, en brachten het op de markt als Brintellix. In 2016 veranderden ze de handelsnaam in Trintellix.
In vier rapporten van cruciale klinische proeven waren 8 van de auteurs werknemers van Takeda of Lundbeck. Van de 5 auteurs die geen werknemer waren, onthulden er 4 dat ze betaald werden door ten minste één van de sponsors voor consulting en/of sprekersdiensten. De enige Amerikaanse psychiater die in deze vier rapporten als auteur werd genoemd was Madhukar Trivedi, die adviseur was voor beide sponsors.
De gepubliceerde resultaten
In drie onderzoeken werden verschillende doseringen van het medicijn vergeleken met placebo gedurende maximaal 8 weken. De onderzoeken bevatten 5 vergelijkingen met placebo die positief uitpakten voor vortioxetine (bij 5 mg, 10 mg, 15 mg en 20 mg). Er was één vergelijking waarbij het middel niet werkzaam bleek (bij 10 mg). Een vierde studie wees uit dat het middel effectief was bij het verminderen van het risico op terugval.
Daarop publiceerden 5 bekende Amerikaanse psychiaters, onder leiding van Alan Schatzberg, samen met een Canadese psychiater, een “overzicht van vortioxetine” in het Journal of Clinical Psychiatry. Zij schreven het volgende:
- Van dit “nieuwe antidepressivum” werd aangenomen dat het “de niveaus van serotonine, noradrenaline, dopamine, acetylcholine en histamine in specifieke gebieden van de hersenen verhoogt”, hetgeen, althans in theorie, “mogelijk unieke, gunstige resultaten zou kunnen opleveren voor patiënten die met het middel worden behandeld”.
- Dat het effectief was gebleken bij de behandeling van depressie “in 6 klinische studies.”
- Dat zijn ” multi-modale farmacologische activiteit voordeel kan opleveren voor de cognitieve functie “.
- Dat zijn “gunstige verdraagbaarheidsprofiel betekenisvolle voordelen kan hebben met betrekking tot gewichtstoename en geringe seksuele disfunctie waar patiënten baat bij kunnen hebben.”
Leslie Citrome publiceerde verschillende reviews met betrekking tot Vortioxetine en concludeerde dat in vergelijking met andere antidepressiva die al op de markt waren, het even effectief was, maar mogelijk beter verdraagbaar en met minder bijwerkingen.
De kritiek
Op het eerste gezicht wijzen de drie kortetermijnproeven op een werkzaam geneesmiddel. Hoewel in de proeven meerdere doses vortioxetine werden vergeleken met één dosis placebo, leverde vortioxetine een statistisch significant voordeel op in vijf van de zes vergelijkingen. Het verschil in die vijf vergelijkingen varieerde van 3,6 punten tot 7,1 punten op de Montgomery-Asberg Depression Rating Scale (MADRS), een geneesmiddel-placebo scheiding waarvan wordt aangenomen dat ze een klinisch belangrijk voordeel oplevert.
Er is het gebruikelijke probleem dat de placebogroep in elk van deze studies was samengesteld uit patiënten die geen medicatie kregen. Er was ook een ontwerpkenmerk in de studies die buiten de Verenigde Staten werden uitgevoerd – en mogelijk ook in de Amerikaanse – dat wijst op een doelbewuste poging om bijwerkingen van vortioxetine te bagatelliseren. In plaats van onderzoekers patiënten te laten ondervragen over specifieke bijwerkingen waarvan bekend is dat ze in verband worden gebracht met antidepressiva (zoals seksuele disfunctie), vertelde het protocol onderzoekers simpelweg aan patiënten te vragen “Hoe voelt u zich?” Door patiënten zelf hun bijwerkingen te laten rapporteren, kan men verwachten dat het aantal bijwerkingen veel lager uitvalt, wat in dit geval leidde tot de conclusie dat dit middel minder vaak seksuele disfunctie veroorzaakt dan andere antidepressiva die al op de markt zijn.
Maar de werkzaamheid in de gepubliceerde trials blijft. Het Institute for Safe Medication Practices ontdekte echter, in een latere beoordeling van de gegevens die aan de FDA waren voorgelegd, dat er tien proeven met vortioxetine waren gedaan, in plaats van de zes die door Schatzberg werden genoemd. In vier van de tien bleek het geneesmiddel geen voordeel op te leveren ten opzichte van een placebo – de sponsors hadden zich geconcentreerd op het publiceren van de positieve resultaten en het verbergen van de negatieve.
In drie van de vijf studies bij patiënten in de VS werd geen voordeel van het geneesmiddel gevonden, en in de andere twee werd geen voordeel van het geneesmiddel aangetoond bij de startdosis van 10 mg of 15 mg. In vijf Amerikaanse studies waarin 10 of meer doses vortioxetine werden vergeleken met placebo, kan het geneesmiddel dus slechts twee tot vier keer een statistisch significant voordeel hebben opgeleverd ten opzichte van placebo. De bewering van werkzaamheid, concludeerde het Institute for Safe Medication Practices, “was in hoge mate afgeleid van buitenlandse trials”.
Het Instituut ontdekte ook dat toen vortioxetine eenmaal op de markt was, bijwerkingen die aan de FDA werden gemeld, wezen op een problematisch medicijn. In een periode van 12 maanden eindigend op 30 september 2017, waren er 45 sterfgevallen in verband gebracht met het gebruik van vortioxetine, nadelige gedragsveranderingen (zelfmoord, zelfverwonding, vijandigheid en agressie), talrijke meldingen van seksuele disfunctie, en het ontstaan van eetstoornissen.
Patient Drug News rapporteerde eveneens een lange lijst van bijwerkingen van vortioxetine en concludeerde dat het medicijn “weinig voordeel” opleverde en “aanzienlijke risico’s” had. Ondertussen informeerde de FDA Lundbeck en Takeda dat ze niet konden beweren dat hun medicijn cognitieve voordelen opleverde, omdat de data een dergelijke bewering niet ondersteunden.
De geldboom
Met de verschillende rapporten die zij publiceerden, fungeerden Trivedi, Citrome en Schatzberg’s groep als Amerikaanse “thought leaders” (richtingbepalende leiders) die vortioxetine als veilig en effectief verklaarden, met mogelijke voordelen ten opzichte van bestaande antidepressiva. Zie hier wat zij van 2013 tot en met 2018 betaald kregen door Takeda en Lundbeck voor hun advies/sprekersdiensten met betrekking tot vortioxetine (ProPublica-database), en het totale bedrag dat zij van 2014 tot en met 2020 van Takeda en Lundbeck ontvingen (Open Payments-database):
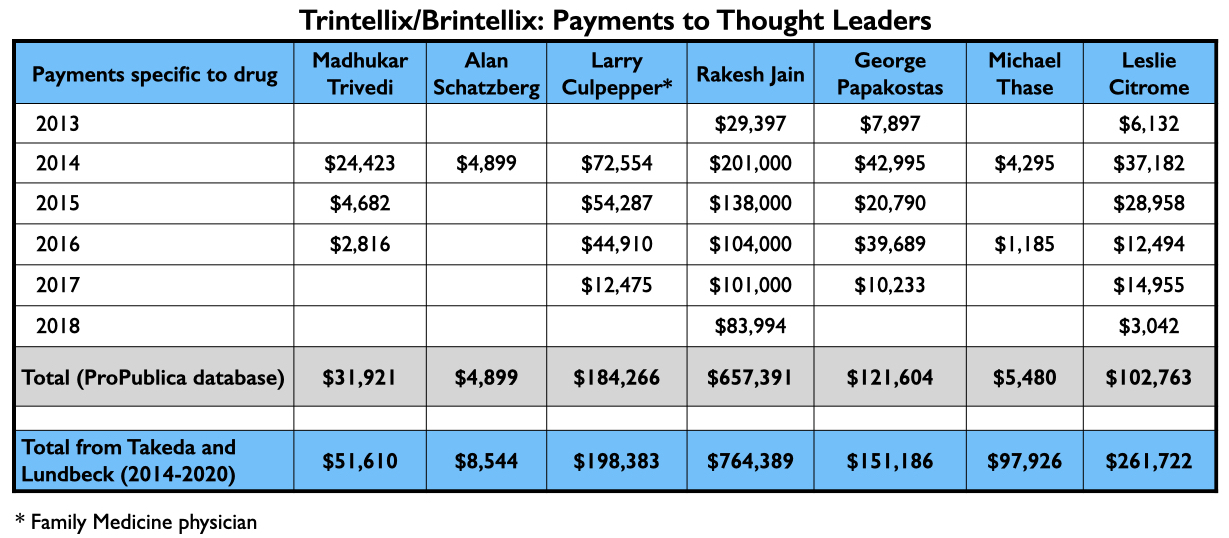
Rakesh Jain, die één van de auteurs was van de Schatzberg-studie, komt ook voor op een lijst van de top vier sprekers betaald door Takeda. Hier is de geldstroom die naar drie anderen ging voor het promoten van vortioxetine van 2013 tot 2018, en het totaal dat zij ontvingen van Takeda en Lundbeck van 2014 tot 2020.
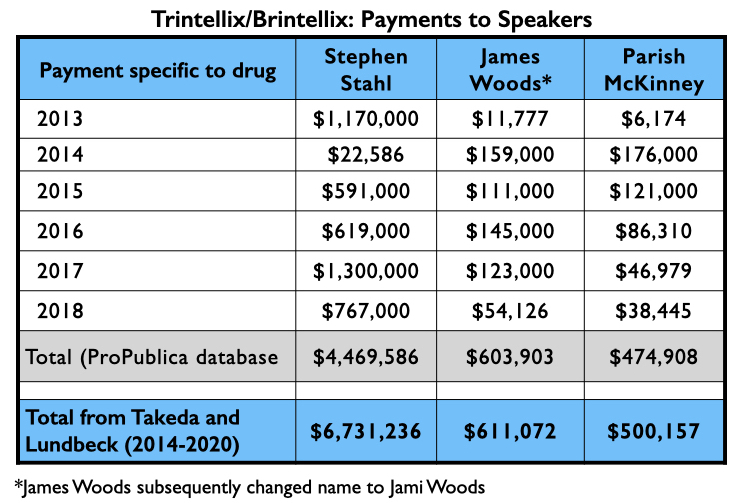
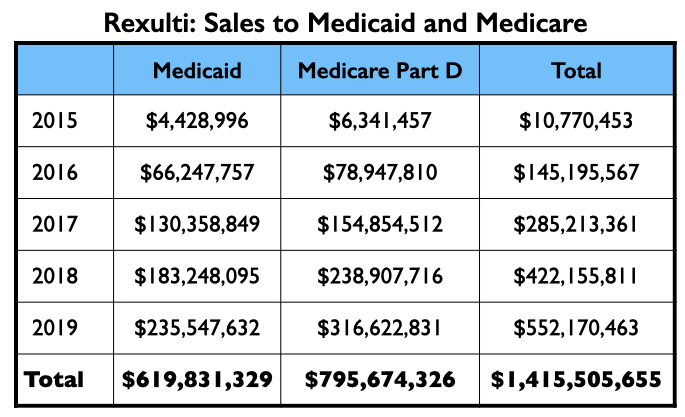
Hoewel dit antidepressivum niet veel werkzaamheid heeft laten zien in klinische tests, heeft het toch succes gehad op de markt. Medicaid en Medicare betaalden meer dan $ 1,25 miljard aan de makers van Trintellix/Brintellix van 2014 tot 2019. De verkoop steeg elk jaar terwijl Stahl en de andere sprekers hun rondes maakten.
Rexulti/RXulti (Brexpiprazol)
Otsuka en Lundbeck, die hadden samengewerkt om Abilify Maintena op de markt te brengen, ontwikkelden ook gezamenlijk brexpiprazol. De FDA keurde het in 2015 goed als behandeling voor schizofrenie en als aanvullende behandeling voor depressie, waarbij de twee bedrijven het op de markt brachten als Rexulti.
In drie rapporten van spilonderzoeken naar brexpiprazol voor schizofrenie waren 10 van de 12 auteurs medewerkers van het bedrijf. De 2 niet-werknemers waren de Amerikaanse psychiaters Christoph Correll en John Kane.
De gepubliceerde resultaten
De fase III-studies werden uitgevoerd bij een populatie van chronische schizofreniepatiënten met een verergering van de symptomen, die vóór de studie bijna allemaal antipsychotica gebruikten. Nadat de patiënten waren gestopt met de antipsychotica die ze hadden gekregen, werden ze gerandomiseerd naar één van de vier doses brexpiprazol (,25 mg, 1 mg, 2 mg, of 4 mg) of placebo.
In een gezamenlijke analyse van de fase III studies hadden de patiënten in de groepen van 2 mg en 4 mg na zes weken “statistisch significante” grotere dalingen in hun PANSS scores dan de patiënten behandeld met placebo. Kane, Correll en de medewerkers van het bedrijf concludeerden dat deze “meta-analyse van de cruciale studies aangeeft dat brexpiprazol 2 mg en 4 mg effectief zijn bij de behandeling van acute schizofrenie.”
De kritiek
Er zijn drie proeven met brexpiprazol die moeten worden onderzocht: één fase II-onderzoek en twee afzonderlijke fase III-onderzoeken (geen gecombineerde analyse). In alle drie de studies is er de gebruikelijke medicijn-onttrekkingsgroep vermomd als een placebogroep. Daarbij worden meerdere doses van het studiemedicijn vergeleken met één dosis placebo. Patiënten met een eerste episode kwamen niet in aanmerking voor de proef (wat ervoor zorgde dat er geen geneesmiddelen-naïeve patiënten in het placebo-cohort zaten).
Het primaire resultaat was vermindering van de symptomen op de PANSS. Zelfs met de bevooroordeelde opzet kwam geen enkele dosis brexpiprazol – noch in de fase II studie, noch in de fase III studies – in de buurt van het verschil van 15 punten dat wordt geacht een “minimaal klinisch belangrijk” voordeel op te leveren.
Zelfs in termen van een statistisch significant voordeel, wat een veel lagere norm is, was de werkzaamheid van brexpiprazol van een marginale omvang. In de fase II studie leverden geen van de 4 doses van brexpiprazol een voordeel op ten opzichte van placebo. In de fase III-studies werden 3 doses vergeleken met placebo: een lage dosis, een dosis van 2 mg, en een dosis van 4 mg. De lage dosis leverde in beide studies geen voordeel op. De dosis van 2 mg leverde in één van de twee fase III-studies ook geen voordeel op. Alleen door de resultaten van de fase III-studies samen te voegen, kwam de dosis van 2 mg in de categorie “statistisch significant” terecht.
In de samengevoegde analyse gaf de 2 mg slechts een verschil van 5,46 punten in vermindering van de symptomen in vergelijking met placebo. De 4 mg gaf slechts een verschil van 6,69 punten. Drie studies van brexpiprazol, met in totaal 10 doses van het geneesmiddel vergeleken met placebo – waarbij de laatste groep bestond uit chronische patiënten die van hun antipsychotische medicatie waren gehaald – en niet één keer leverde een dosering een klinisch betekenisvol voordeel op.
De geldboom
Nadat de fase II- en fase III-resultaten waren gepubliceerd, schreef Citrome verschillende artikelen over brexpiprazol, waarin hij het werkingsmechanisme, de werkzaamheid op secundaire eindpunten, enzovoort beoordeelde. Dit alles leidde hem tot de conclusie dat brexpiprazol “bijzonder gunstig kan zijn voor patiënten die tijdens eerdere medicatietests hebben geworsteld met rusteloosheid of akathisia, of patiënten die op zoek zijn naar een alternatieve medicatie die niet sterk verdovend is.”
Bekijk hieronder het geld dat naar Kane, Correll en Citrome vloeide voor advies- en/of sprekersdiensten met betrekking tot brexpiprazol van 2015 tot en met 2018 (ProPublica-database) en het totaal dat zij ontvingen van Lundbeck en Otsuka van 2014 tot en met 2020 (Open Payments-database).
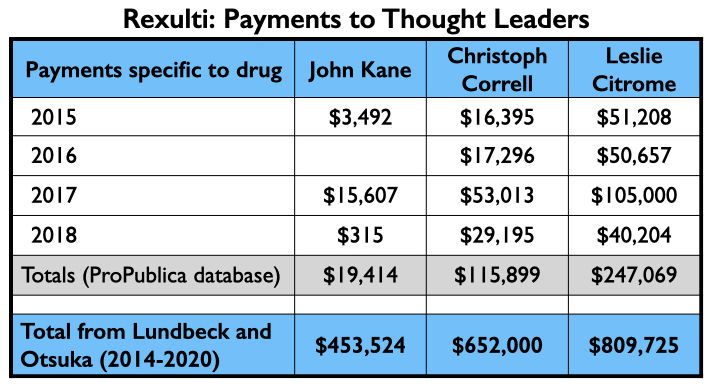
Aangezien Otsuka en Lundbeck eerder samen Abilify Maintena op de markt hadden gebracht, namen zij opnieuw regelmatig hetzelfde topverdienende kwartet van sprekers in dienst: Roma, Nguyen, Brams, en El-Mallakh. Hun best verdienende Rexulti-spreker van 2015 tot en met 2018 was wellicht Gregory Mattingly, een psychiater die klinische proeven uitvoerde voor de “Midwest Research Group.”
Hier is het geld dat deze sprekers verdienden voor het promoten van Rexulti van 2015 tot en met 2018, en het totaal dat ze verdienden aan Lundbeck en Otsuka van 2014 tot en met 2020.
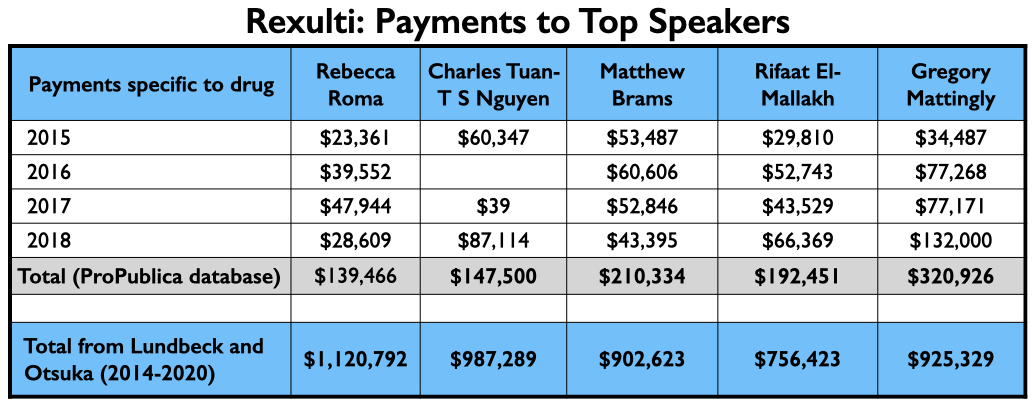
De verkoop van Medicaid en Medicare van Rexulti groeide gestaag van 2015 tot 2019, met meer dan $ 1,4 miljard aan totale verkoop.
Vraylar/Reagila (Cariprazine)
Er waren drie bedrijven betrokken bij de ontwikkeling en het testen van cariprazine: Gedeon Richter, Forest Laboratories, en Allergan. Het werd in 2015 goedgekeurd voor de behandeling van schizofrenie en manie-symptomen van bipolaire patiënten, en in 2019 voor de behandeling van depressie bij bipolaire patiënten. Allergan bracht het op de markt als Vraylar.
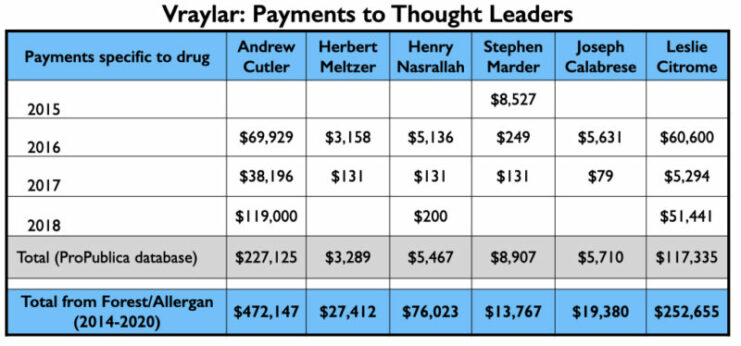
In zes rapporten van pivotale studies voor schizofrenie en bipolair waren 18 van de 30 auteurs werknemers van een van deze drie bedrijven. Hiervan waren er 2 patenthouder van het geneesmiddel. Van de 12 niet-werknemers die als auteurs werden genoemd, meldden 11 dat ze financiële banden hadden met ten minste één van de bedrijven. De enige onderzoeker die geen banden had, Henry Nasrallah, kreeg vervolgens $ 75.823 betaald van Allergan, voornamelijk voor sprekersdiensten.
De gepubliceerde resultaten
In de drie fase II/fase III onderzoeken voor schizofrenie werden patiënten met een voorgeschiedenis van “behandelingsresistentie” tegen antipsychotica uitgesloten van inschrijving. Ook patiënten met een eerste episode werden uitgesloten. De studies werden uitgevoerd bij chronische patiënten bij wie de antipsychotica die zij gebruikten werden ingetrokken en die vervolgens werden gerandomiseerd naar een van de vier doses cariprazine of naar placebo. In een gepoolde analyse van de drie onderzoeken hadden de cariprazinepatiënten aan het eind van zes weken hun PANSS-scores zien dalen met 6,5 tot 9,5 punten. Dit was meer dan bij de patiënten in de placebogroep (de variabiliteit weerspiegelt de scores voor de verschillende doseringen). De onderzoekers concludeerden dat “cariprazine effectief was versus placebo in alle vijf PANSS-factor domeinen, wat suggereert dat het een breed-spectrum werkzaamheid zou kunnen hebben bij patiënten met acute schizofrenie.”
De bedrijven voerden ook een studie uit naar cariprazine voor het verminderen van terugval. De chronische patiënten werden eerst behandeld met cariprazine, en alleen degenen die stabiliseerden en gedurende 20 weken stabiel bleven op het geneesmiddel werden gerandomiseerd in de dubbelblinde studie. Gedurende de volgende paar maanden was het terugvalpercentage twee keer zo hoog voor de placebogroep die het geneesmiddel niet gebruikte dan voor de groep die cariprazine bleef gebruiken (48% versus 25%). “Langdurige behandeling met cariprazine was significant effectiever dan placebo voor terugvalpreventie bij patiënten met schizofrenie,” concludeerden de auteurs.
In drie cruciale studies van cariprazine voor depressie bij bipolair 1, waren er zeven vergelijkingen van cariprazine met placebo (in doses van 0,75 mg, 1,5 mg en 3 mg). In vier van de zeven vergelijkingen leverde cariprazine een statistisch significant voordeel op, en in de drie andere niet. In de vier “succesvolle” vergelijkingen varieerde het verschil in symptoomvermindering tussen het geneesmiddel en placebo van 2,4 tot 4,0 punten op de 60-punts MADRS schaal. Cariprazine “was effectief, werd over het algemeen goed verdragen, en was relatief veilig in het verminderen van depressieve symptomen in volwassenen met een bipolaire 1-depressie,” concludeerden de onderzoekers.
De kritiek
De fase II/fase III trials van cariprazine waren vergelijkbaar in opzet met de brexpiprazol trials: Eerste-episode patiënten werden uitgesloten; meerdere doses van het geneesmiddel werden vergeleken met een enkele dosis placebo; en de placebogroep was samengesteld uit chronische patiënten die abrupt van hun antipsychotische medicatie waren gehaald. Bovendien werden alleen patiënten die eerder goed hadden gereageerd op antipsychotica toegelaten tot het onderzoek (mensen met een voorgeschiedenis van slechte respons werden bijvoorbeeld uitgesloten). De gepoolde gegevens vertelden over een werkzaamheid die vergelijkbaar was met die van brexpiprazol bij 2 mg en 4 mg: De verschillen op de PANSS schaal waren statistisch significant maar bleven onder het 15-punts “minimaal klinisch belangrijk verschil”.
De terugvalstudie werd uitgevoerd in een selecte groep van goede responders op cariprazine. Van de 765 chronische patiënten die in de studie werden ingeschreven, stabiliseerden er slechts 200 met succes op cariprazine en bleven stabiel gedurende de vereiste 20 weken voordat ze werden gerandomiseerd in de dubbelblinde studie. Slechts 18 van degenen die werden gerandomiseerd naar cariprazine voltooiden de 72 weken durende terugval studie; de overige 89 in de medicijn-arm vielen terug, stopten vanwege bijwerkingen, trokken hun toestemming in, of werden verloren voor follow-up.
Kortom, slechts 26% van de chronische patiënten die werden gerekruteerd voor de studie stabiliseerden lang genoeg om deel te nemen aan de terugvalstudie. Van de 101 patiënten die vervolgens werden gerandomiseerd voor voortzetting van de behandeling met cariprazine, slaagde 82% er niet in de studie te beëindigen. Dat is een gedocumenteerd stay-well percentage na 72 weken voor de met cariprazine behandelde groep van 3%.
Wat betreft de studies van cariprazine als een behandeling voor depressie bij bipolaire patiënten, leverden slechts vier van de zeven doseringen een statistisch significant voordeel op. Het verschil in vermindering van de symptomen op de MADRS-schaal tussen het geneesmiddel en het placebo, was zelfs in die gevallen waarin het verschil statistisch significant was, van marginale aard.
Het is ook opmerkelijk dat 5 van de 6 hoofdauteurs van de door MIA onderzochte rapporten werknemers van het bedrijf waren. Eén of beide eigenaars van het patent op het middel werden als auteur vermeld in vijf van de rapporten.
De geldboom
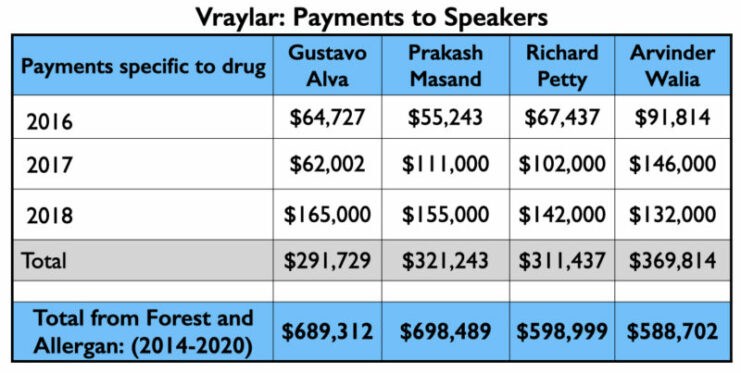
Dit is de geldstroom naar de 5 Amerikaanse psychiaters die genoemd werden als auteurs van één of meer van de 6 gepubliceerde onderzoeken, en naar Leslie Citrome, die 17 artikelen over cariprazine publiceerde, inclusief 10 waarvan hij de enige auteur was.
De 4 psychiaters die bovenaan de sprekerslijst van Vraylar staan, zijn allemaal bekende namen uit de Miljoen Dollar Club.
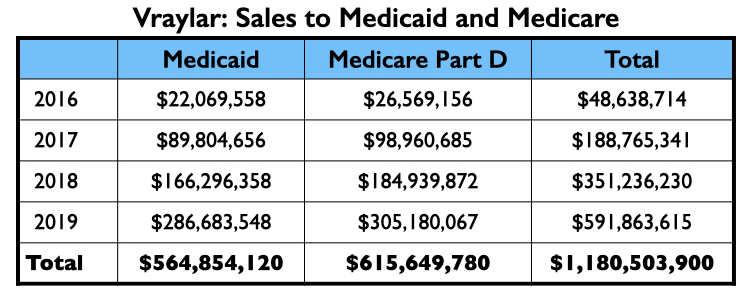
De verkopen van Medicare en Medicaid bedroegen in totaal $ 1.18 miljard tijdens de eerste vier jaar dat het medicijn op de markt was.
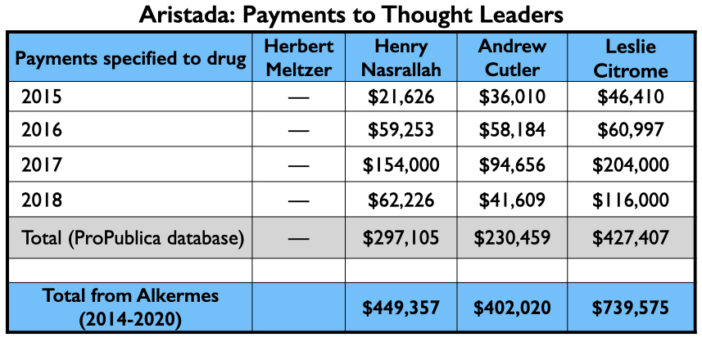
Aristada (Aripiprazol Lauroxil)
Alkermes verkreeg in 2015 goedkeuring van de FDA voor aripiprazol lauroxil en bracht het op de markt als Aristada. Dit was een tweede injecteerbare vorm van aripiprazol. Het werd aangeprezen als een verbetering ten opzichte van de maandelijkse Abilify Maintena omdat het langer in het lichaam werkzaam zou blijven.
In een verslag over het cruciale fase III-onderzoek, dat werd gepubliceerd in het Journal of Clinical Psychiatry, waren 8 van de 10 auteurs werknemers van Alkermes. De 2 niet-werknemers waren de Amerikaanse psychiaters Herbert Meltzer en Henry Nasrallah. Meltzer was een consulent van Alkermes tijdens het onderzoek; Nasrallah was een adviseur van het bedrijf en maakte deel uit van het sprekersbureau van Alkermes.
De gepubliceerde resultaten
De chronische patiënten die voor het onderzoek werden gerekruteerd, moesten eerder een “klinisch gunstige reactie” op een antipsychoticum hebben gehad. Patiënten die eerder een “inadequate respons op oraal aripiprazol” hadden gehad, werden uitgesloten. Na het stoppen met de antipsychotische medicatie die ze hadden gekregen, werden de ingeschreven patiënten gerandomiseerd naar aripiprazol lauroxil of naar placebo. De patiënten die waren gerandomiseerd voor de injecteerbare aripiprazol kregen ook een orale dosis aripiprazol gedurende de eerste drie weken.
Aan het einde van de 12 weken waren de PANSS-scores in de injecteerbare groep met 22 punten gedaald, wat 12 punten meer was dan de daling in de placebogroep. “Deze studie toonde een robuuste werkzaamheid aan van meerdere doses aripiprazol lauroxil met een veiligheids- en verdraagbaarheidsprofiel van oraal aripiprazol,” schreven Meltzer, Nasrallah, en de medewerkers van het bedrijf. “Het klinische profiel van aripiprazol in combinatie met de flexibiliteit die wordt geboden door de nieuwe technologie en de mogelijkheid tot toediening in de deltaspier en de bilspier kan een nieuwe behandelingsoptie zijn voor zowel clinici als hun patiënten met schizofrenie.”
Leslie Citrome, Andrew Cutler en Nasrallah hebben vervolgens samen met 4 werknemers van Alkermes een nadere analyse van de fase III-gegevens in CNS Spectrums gepubliceerd, die informatie bevatte over “ondersteunende eindpunten voor de werkzaamheid”.
De kritiek
Deze fase III-studie had de gebruikelijke opzet voor een antipsychoticatest: Chronische patiënten die in het verleden positief hadden gereageerd op een antipsychoticum werden abrupt van de antipsychotische medicatie afgehaald, en vervolgens werd een vergelijking gemaakt tussen degenen die weer op een antipsychoticum werden gezet en degenen die in een toestand van medicatie-ontwenning verkeerden. Het resultaat is bijna altijd hetzelfde. De neurale paden in de hersenen van deze chronische patiënten hebben zich aangepast aan de aanwezigheid van dopamine-blokkerende medicijnen, en dus zullen degenen die worden teruggezet op een medicijn met dergelijk werkingsmechanisme een grotere vermindering van de symptomen op de PANSS-test hebben dan de “placebo”-groep.
Deze opzet zorgt er ook voor dat de placebogroep – omdat het een groep is die geen medicijn krijgt – vaak last zal hebben van “ongewenste voorvallen”. In deze studie was het percentage patiënten met een “treatment-emergent adverse event” het hoogst voor de placebogroep (62,3%). Hiertoe behoorden gebeurtenissen als slapeloosheid, akathisia, hoofdpijn en angst. Deze hoge incidentie van ongewenste voorvallen in de placebogroep draagt ertoe bij dat de medicamenteuze behandeling als relatief veilig en verdraagbaar wordt beoordeeld. (Deze zelfde factor kan worden gezien in de studies van brexpiprazol en cariprazine).
Dit was ook geen onderzoek naar aripiprazol lauroxil als een op zichzelf staande behandeling. Het verschil in afname van PANSS-scores tussen de medicijn- en placebogroepen trad vooral op in de eerste drie weken, toen de aripiprazol lauroxil patiënten ook werden behandeld met oraal aripiprazol. Eenmaal alleen het injecteermiddel toegediend, was er weinig blijvende afname in hun PANSS-scores.
Hoewel het 12-punts verschil in PANSS-scores aan het einde van 12 weken statistisch significant was, was het nog steeds niet het “minimaal klinisch belangrijke” 15-punts verschil. Aan het einde van de 12 weken was de gemiddelde PANSS-score voor de aripiprazol lauroxil patiënten 71, wat wordt beschouwd als “matig ziek”. Slechts 36% van de aripiprazole lauroxil patiënten werden geacht te hebben gereageerd op het geneesmiddel (een daling van 30% in PANSS-scores), tegenover 18% van de placebo patiënten.
De geldboom
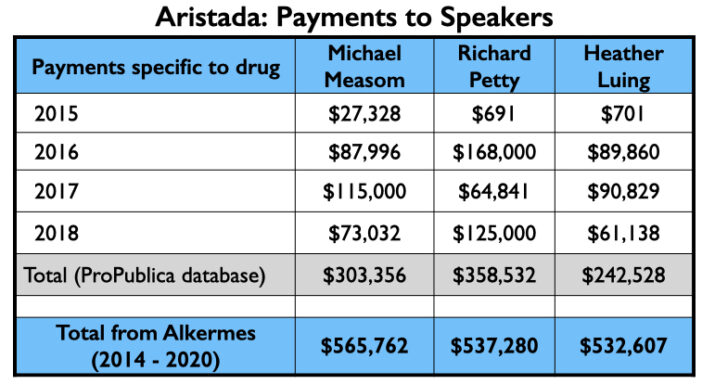
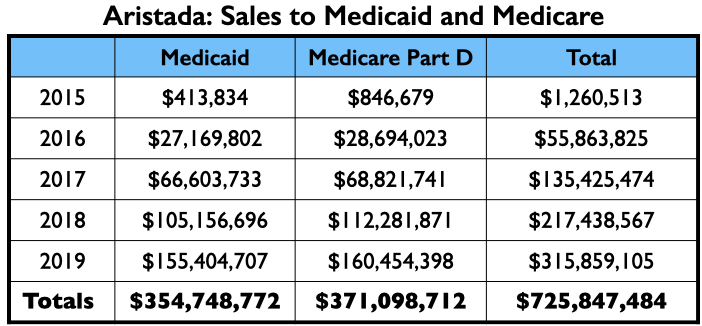
Hier volgt de geldboom voor Aristada: betalingen aan de 4 Amerikaanse psychiaters die de auteurs waren van de twee artikelen; de betalingen aan de top 3 sprekers (anders dan Citrome, die een actieve spreker was voor Aristada), en de Medicaid en Medicare verkopen.
Austedo (Deutetrabenazine)
Teva verkreeg in 2017 goedkeuring van de FDA voor deutetrabenazine als behandeling voor tardieve dyskinesie, en bracht het op de markt als Austedo. Het bedrijf leunde vooral op neurologen om de werkzaamheid ervan te testen voor het stillen van abnormale motorische bewegingen. Vervolgens promootte het bedrijf het zwaar bij psychiaters die populair zijn in het sprekerscircuit.
Het gepubliceerde rapport van een cruciale studie van 12 weken vermeldde 15 auteurs. Het ging om 2 werknemers, 8 neurologen die door Teva werden betaald als consultant en/of spreker, nog 1 was een doctoraal consulent, en de overige 4 waren Amerikaanse psychiaters.
De gepubliceerde resultaten
In de studie werden patiënten die leden aan tardieve dyskinesie gerandomiseerd naar deutetrabenazine of placebo. Ze mochten de psychiatrische medicatie die ze gebruikten blijven innemen. Aan het eind van de 12 weken had de deutetrabenazine-groep een daling van 3,0 punten op de Abnormal Involuntary Movement Scale (AIMS), vergeleken met een daling van 1,6 punten voor placebo, een verschil dat statistisch significant was. “Bij patiënten met TD werd deutetrabenazine goed verdragen en verminderde het de abnormale bewegingen”, concludeerden de auteurs.
De kritiek
AIMS beoordeelt de motorische functie op zeven gebieden, met scores van 0 tot 4 in elk domein. Een totaalscore van 7 op de 28-puntenschaal duidt op minimale symptomen, met abnormale bewegingen die “niet vaak voorkomen en niet gemakkelijk zijn waar te nemen”. Een totaalscore van 14 wijst op “lichte” TD – abnormale bewegingen die “niet vaak voorkomen maar wel gemakkelijk zijn waar te nemen”.
De gemiddelde AIMS-score voor de patiënten in het 12 weken durende onderzoek was 9,6. Dit betekent dat dit onderzoek werd uitgevoerd in een groep met minimale tot milde symptomen. Het verschil van 1,4 punten in vermindering van de symptomen tussen het medicijn en placebo, hoewel statistisch significant, is niet van “minimaal” klinisch belang. Onderzoekers hebben bepaald dat er ten minste een verschil van 2 punten op de AIMS moet zijn om klinisch betekenisvol te zijn.
Bovendien waren de verschillen in verbetering tussen de deutetrabenazine- en placebogroep niet statistisch significant op de twee andere secundaire effectschalen die werden gebruikt, de Clinical Global Impression of Change en de Patient Global Impression of Change. Noch de onderzoekers, noch de patiënten, merkten enig verschil op toen hen werd gevraagd of ze beter waren geworden, gelijk waren gebleven of slechter waren geworden met het medicijn.
De geldboom
Hier volgt een overzicht van het geld dat Teva de 8 neurologen tegen eind 2020 had betaald voor hun advies- of spreekdiensten:
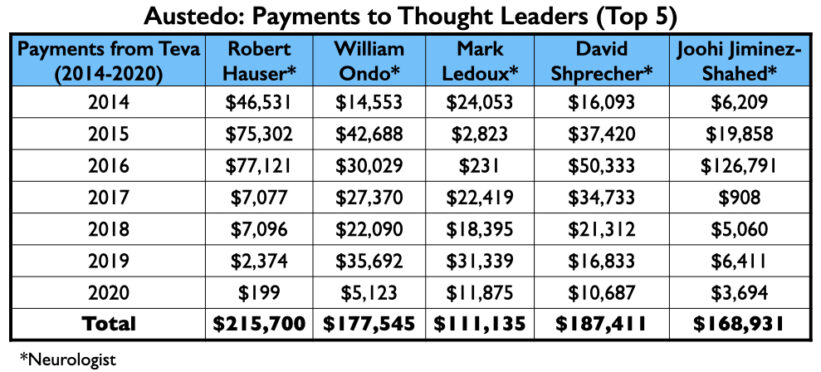
Teva’s sprekerslijst bevatte 4 psychiaters van de Miljoen Dollar Club: Richard Jackson, Rakesh Jain, Arvinder Walia en Andrew Cutler.
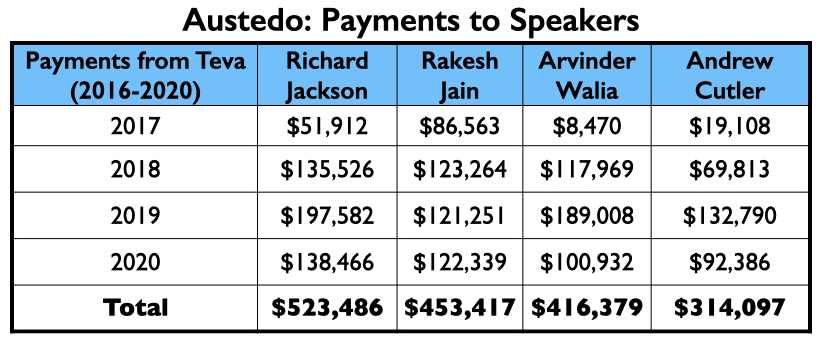
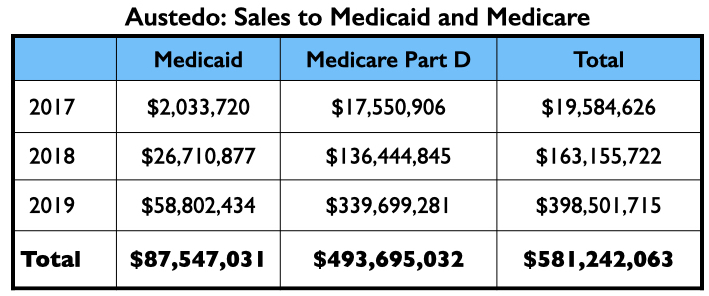
In de eerste twee volle jaren dat Austedo op de markt was, genereerde het bijna $ 600 miljoen aan omzet voor Medicaid en Medicare.
Ingrezza (Valbenazine)
Valbenazine, ontwikkeld door Neurocrine Biosciences en in de handel onder de naam Ingrezza, werd tegelijk met deutetrabenazine goedgekeurd als behandeling voor tardieve dyskinesie.
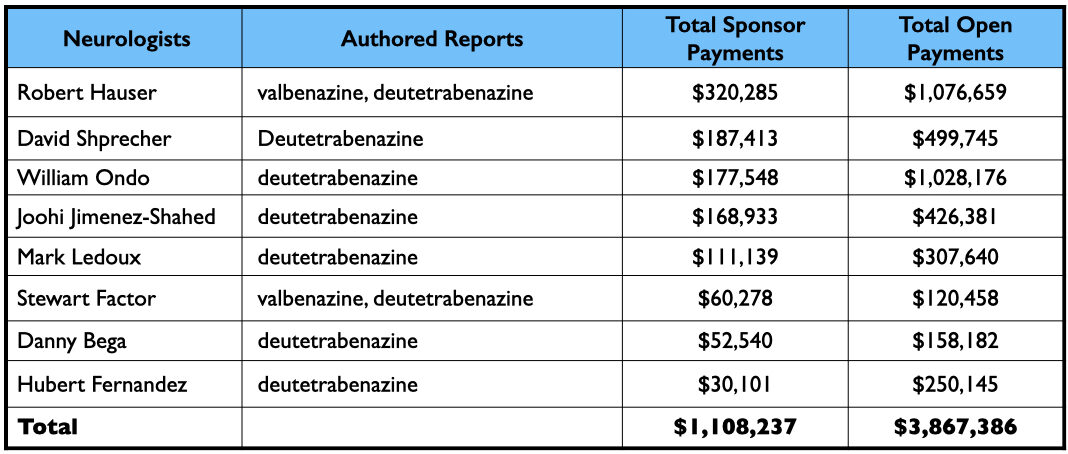
Van de 9 auteurs van een fase III-rapport over valbenazine waren er 4 werknemer van Neurocrine. Daarnaast hadden 4 anderen financiële banden met het bedrijf, waaronder de hoofdauteur, neuroloog Robert Hauser.
De gepubliceerde resultaten
In de fase III-studie werden twee doses valbenazine vergeleken met een placebo. De dosis van 80 mg leidde tot een daling van de symptomen op de AIMS-schaal met 3,2 punten na zes weken; de dosis van 40 mg tot een daling met 1,9 punten. Omdat de placebogroep in deze studie niet verbeterde (.1 punt afname in symptomen), was het 3,1-punts verschil tussen de 80 mg dosis valbenazine en placebo robuuster dan de resultaten in de deutetrabenazine-trials. “Eenmaal daagse valbenazine verbeterde de tardieve dyskinesie significant in deelnemers met onderliggende schizofrenie, schizoaffectieve stoornis, of stemmingsstoornis,” concluderen de onderzoekers.
De kritiek
De patiënten in deze studie hadden een gemiddelde AIM- score van 10,0. Het was dus een groep met minimale tot milde symptomen. Hoewel de AIMS score bij beide doseringen een statistisch significant voordeel liet zien, overschreed alleen de dosis van 80 milligram het tweepuntsverschil dat vereist is om van een “minimaal klinisch belangrijk verschil” te kunnen spreken.
Op een tweede eindpunt, de “Klinische Globale Indruk van Verandering-Tardieve Dyskinesie”, waren er geen significante verschillen tussen beide medicijndoses of placebo aan het eind van week zes. Dit is een beoordeling door clinici van de algemene verandering in de klinische status van de patiënten, variërend van zeer veel verbeterd tot zeer veel verslechterd op een schaal van één tot zeven. Het feit dat er geen significant verschil was op deze schaal, toont aan dat de onderzoekers in deze dubbelblinde proef geen klinisch verschil hebben opgemerkt tussen de twee groepen bij geen van beide doses.
De geldboom
De betalingen van Neurocrine aan haar vak-influencers ofwel thought leaders, waren over het algemeen minder dan wat er werd betaald aan de thought leaders voor de overige zes geneesmiddelen die van 2013 tot 2017 werden goedgekeurd.
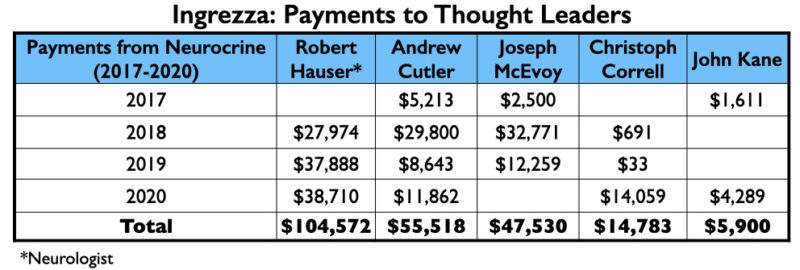
De top vier van de sprekerslijst bevatte er evenwel drie van de miljoenenclub (Citrome, Jain, en Reynolds) en een vierde die evengoed niet veel te kort kwam, Craig T. Chepke. Zowel Citrome als Chepke schreven artikelen over valbenazine. Dat van Chepke verscheen in CNS Spectrums.
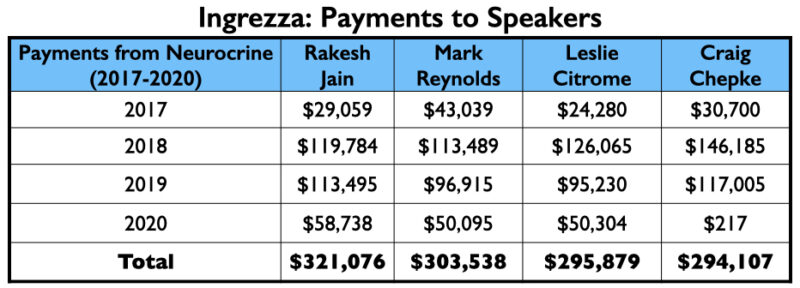
Ingrezza kende een snelle verkoopstijging en genereerde meer dan $ 1 miljard aan Medicaid en Medicare betalingen in zijn eerste twee volledige jaren op de markt.
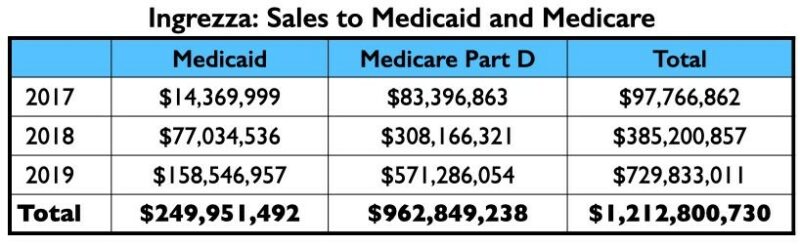
De moraal van het verhaal
De Open Payments-database maakt het mogelijk om te achterhalen hoeveel farmaceutisch geld er wordt betaald aan individuele psychiaters gedurende het testen en het op de markt brengen van nieuwe medicijnen. Wat dit overzicht onthult is dat geld stroomt naar de consultants en adviseurs die de bedrijven helpen bij het opzetten van hun trials en het schrijven van artikelen over de resultaten; het stroomt naar degenen die reviews en verdere analyses van het nieuwe medicijn publiceren zodra de testresultaten zijn gepubliceerd; en het stroomt naar degenen die dienst doen bij sprekersbureaus.
Hoewel de $ 340 miljoen die de farmaceutische bedrijven van 2014 tot 2020 aan psychiaters hebben betaald voor individuele psychiaters misschien een aanzienlijk inkomen heeft opgeleverd, is het een kleine uitgave voor de medicijnfabrikanten. De betalingen voeden het vertellen van een verhaal, gewikkeld in het wetenschappelijke gaas van “dubbelblinde, placebogecontroleerde, gerandomiseerde onderzoeken”, over medicijnen die veilig en effectief zijn voor een bepaalde aandoening, met mogelijke voordelen ten opzichte van bestaande medicijnen. Zoals te zien is aan de betalingen door Medicaid en Medicare voor de 7 goedgekeurde medicijnen, genereert dit verhaal vervolgens miljarden aan verkoop.
Wat deze kritiek ook onthult is dat het testen van psychiatrische medicijnen een schertsvertoning is. Het is een proces dat niet is ontworpen om te informeren, maar – zolang het medicijn de FDA beoordeling doorstaat – om een commercieel waardevolle reclamekreet te produceren. Deze onderzoeken waren doorspekt met elementen van ondeugdelijke wetenschap.
De studies naar de vier antipsychotica gebruikten allemaal in- en exclusiecriteria om een groep van potentieel “goede responders” op de psychiatrische medicamenten te selecteren. In verschillende gevallen werd een groep geselecteerd die al enkele maanden voor de randomisatie goed gestabiliseerd was op de studiemedicatie.
De uitsluiting van patiënten met een eerste episode uit dergelijke trials is ook opmerkelijk. Als antipsychotica geen rol spelen, is dit juist de groep die werkelijk uit kan testen of een antipsychoticum de symptomen verbetert in vergelijking met een placebo. Een review door Cochrane concludeerde in 2011 dat er in feite geen goed bewijs is dat antipsychotica effectief zijn bij patiënten met een eerste episode. Door deze patiënten uit te sluiten van hun proeven en alleen chronische patiënten in te schrijven, kunnen de farmaceutische bedrijven hopen dat ze gespaard zullen blijven van een dergelijke mislukking.
Proeven met antipsychotica zijn natuurlijk bijna altijd gebaseerd op placebogroepen bestaande uit patiënten die abrupt van de medicatie zijn afgevoerd (of die in een periode van zeven dagen zijn stopgezet). Hier is de morele grondslag voor het beoordelen van deze praktijk: Als een psychiater in zijn dagelijkse praktijk een chronische schizofreniepatiënt abrupt de antipsychotische medicatie zou ontnemen, en die persoon vervolgens weken en maanden onbehandeld zou laten, zou dat als wanpraktijk worden beschouwd. Toch staat juist die klinische wanpraktijk aan de basis van gerandomiseerd gecontroleerd onderzoek naar antipsychotica. Iedereen sluit de ogen voor dit feit en doet alsof de teruggetrokken groep een afspiegeling is van het “onbehandelde” verloop van schizofrenie. De koning is zogezegd helemaal naakt en toch doet de psychiatrische gemeenschap, wanneer ze spreekt over “bewijs uit dubbelblind, placebogecontroleerd, gerandomiseerd onderzoek”, net alsof de koning gekleed is in een prachtig wetenschappelijk gewaad.
Het meest opmerkelijke aspect van de klinische proeven met brexpiprazol en cariprazine is dat zelfs mét de bevooroordeelde in- en uitsluitingscriteria, en zelfs mét het gebruik van een placebogroep zonder medicijn, deze twee psychiatrische middelen er nog steeds niet in slaagden een “minimaal klinisch belangrijk verschil” te geven in de symptomen op de PANSS-schaal ten opzichte van placebo.
Het uitblijven van een klinisch betekenisvol voordeel was ook duidelijk in de fase III-studies van Aristada en Austedo. Deze 2 geneesmiddelen haalden ook hun doel niet, evenals Abilify Maintena in de onderhoudsstudie bij schizofrenie. Dat brengt het totaal op 5 van de 7 goedgekeurde geneesmiddelen die geen “minimaal klinisch belangrijk” voordeel boden in klinische studies. Wat Ingrezza betreft, slechts één van de twee doses haalde die norm, en zelfs met de dosis die dat wel deed, bleek uit de beoordelingen door clinici en de patiënten of ze verbeterd of verslechterd waren, geen verschil tussen de valbenazine en placebo groepen.
Toch kwam geen van deze kritieken voor in de samenvattingen van de gepubliceerde rapporten over deze 6 psychiatrische medicijnen, noch in de conclusies die de auteurs trokken. Er was geen discussie over een gebrek aan klinisch voordeel. In plaats daarvan vertelden de auteurs keer op keer over medicijnen die “veilig en effectief” waren gebleken in “gerandomiseerde, dubbelblinde, placebogecontroleerde onderzoeken”.
Wat de proeven met vortioxetine betreft, publiceerden Otsuka en Lundbeck alleen die met een positief resultaat. Het falen van dit geneesmiddel in Amerikaanse proeven werd verborgen gehouden voor het publiek. Dit brengt een ander slecht-wetenschappelijk element naar boven: Hoe kunnen de resultaten ooit worden vertrouwd, gezien het feit dat medewerkers van het bedrijf de rapporten schrijven en beslissen welke resultaten worden gepubliceerd? Het is mogelijk dat bij bestudering van FDA-gegevens voor de andere zes geneesmiddelen ook negatieve onderzoeken aan het licht zouden komen die nooit zijn gepubliceerd, en dat als dergelijke bevindingen bekend zouden zijn, de risico-batenverhouding voor de zes geneesmiddelen nog slechter uit zou pakken.
Dit alles wijst op een proces dat een commercieel doel dient, in plaats van de samenleving te voorzien van een eerlijke wetenschappelijke beoordeling van de risico’s en voordelen van een geneesmiddel, alsmede de vraag te beantwoorden of het voordeel klinisch zinvol is. Het “kader” van de wetenschap wordt gebruikt om het publiek te misleiden in plaats van te informeren.
Als commercieel streven levert het echter dit resultaat op: Amerikaanse belastingbetalers hebben $ 9,3 miljard uitgegeven aan deze zeven geneesmiddelen vanaf het moment dat ze werden goedgekeurd tot 2019 als betalingen aan Medicaid en Medicare, en op basis van de cijfers voor 2019 en de groeipercentages in de verkoop, hebben belastingbetalers nog eens $ 5 miljard uitgegeven in 2020.
En dat is de “bottom line” als je het geld volgt: er stroomt geld naar individuele psychiaters en naar de farmaceutische bedrijven en aan de basis van deze commerciële onderneming staat “wetenschap” die is ontworpen om te misleiden.
MIA-rapporten worden mede mogelijk gemaakt door een subsidie van de Open Society Foundations

